
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 核外电子总是先排在能量低的电子层上 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
分析 A、原子核外区域能量不同,离核越近能量越低,离核越远能量越高;
B.根据电子首先进入能量最低、离核最近的轨道判断;
C.根据电子首先进入能量最低、离核最近的电子层上判断;
D.根据通常认为最外层有8个电子(最外层是第一电子层时有2个电子)的结构是一种稳定结构.
解答 解:A、原子核外区域能量不同,离核越近能量越低,离核越远能量越高,所以在多电子的原子里,能量高的电子通常在离核远的区域内活动,故A错误;
B.核外电子总是先排在能量低的,但排满了M层的p轨道后就排N层的s轨道,后再排M层的d轨道,不是排满了M层后才排N层,故B错误;
C.核外电子总是先排在能量低的,离核最近的电子层上,故C正确;
D.通常认为最外层有8个电子(最外层是第一电子层时有2个电子)的结构是一种稳定结构,故D错误;
故选:C.
点评 本题考查核外电子排布规律以及元素化学性质和原子构成的关系,要知道电子首先进入能量最低、离核最近的轨道,难度不大.


科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 分子式 | C4H8 | C4H8Cl2 | C4H10O | C5H10O2 |
| 限定条件 | 能发生加成反应 | 只有一个甲基 | 能与钠反应 | 只有一种官能团 |
| 数目 | 3 | 5 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
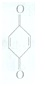 (对苯醌)═N2H4+
(对苯醌)═N2H4+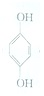 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为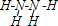 ,该电池正极的电极反应式为
,该电池正极的电极反应式为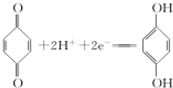 .
.| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
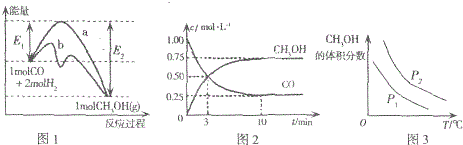
| A. | 图1中曲线b表示使用了催化剂;该反应属于放热反应 | |
| B. | 当压强不同(P1<P2)时,平衡时甲醇的体积分数随温度变化的曲线如图3 | |
| C. | 一定温度下,容器中压强恒定时该反应已达平衡状态 | |
| D. | 该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
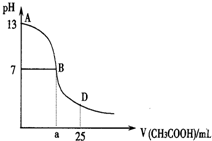 如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )
如图为向25mL0.1•L-1 NaOH溶液中逐滴滴加0.2mol•L-1 CH3COOH溶液过程中溶液pH的变化曲线.AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是( )| A. | c(OH-)大于、小于或等于c(CH3COO-) | B. | c(OH-)一定等于c(CH3COO-) | ||
| C. | c(OH-)一定小于c(CH3COO-) | D. | c(OH-)一定大于c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | H2CO3 | 水杨酸(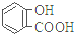 ) ) |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka1=1.3×10-3 Ka2=1.1×10-13 |
| A. | 常温下,等浓度、等体积的NaHCO3 溶液pH小于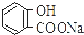 溶液pH 溶液pH | |
| B. | 常温下,等浓度、等体积的Na2 CO3 溶液和 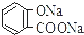 溶液中所含离子总数前者小于后者 溶液中所含离子总数前者小于后者 | |
| C. | 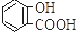 +2NaHCO3→ +2NaHCO3→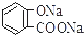 +2H2O+2CO2↑ +2H2O+2CO2↑ | |
| D. | 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
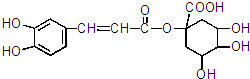 所示:
所示: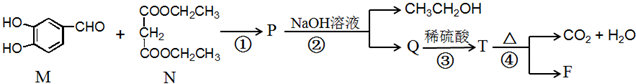

 .
.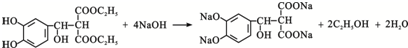 .
.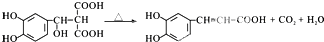 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2固体中含离子总数为3NA | |
| B. | 0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 40g NaOH溶于1L水中,所得NaOH 溶液的物质的量浓度为1mol/L | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
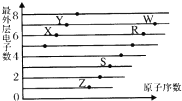 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | 该图体现出原子核外电子层呈现周期性变化 | |
| B. | 简单离子半径:W->R2->Z+>S3+ | |
| C. | R、Z形成的化合物中可能含有共价键 | |
| D. | 由酸性:HWO4>H2RO3可证明非金属性:W>R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com