
分析 根据金属R与盐酸反应生成RCl2型化合物可判断金属R在反应中表现出的化合价为+2价;利用一定量金属与足量酸完全反应产生氢的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量,可以计算金属R的相对原子质量;并根据相对原子质量=质子数+中子数,求质子数和中子数;原子序数=质子数,确定元素.
解答 解:金属R与盐酸反应生成RCl2型化合物,可知金属R的化合价为+2,m(H2)=$\frac{1.2L}{22.4L/mol}×2g/mol$=$\frac{3}{28}$;
设金属R的相对原子质量为m,因为产生氢的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量,则$\frac{3}{28}$=$\frac{2}{m}×1.2$,解得m=56,
又因为相对原子质量=质子数+中子数,且质子和中子数相等,故质子数=中子数=核外电子数=56×$\frac{1}{2}$=28,为元素Fe.
答:质子数、中子数和核外电子数各是28、28、28,元素Fe,相对原子质量是56.
点评 此类问题利用:金属与足量酸完全反应产生氢的质量=$\frac{金属的化合价}{金属的相对原子质量}$×金属的质量,解决起来会更简便.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 5ml | B. | 15ml | C. | 20ml | D. | 25ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 同一元素的各种同位素的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第2周期元素从左到右,最高正化合价从+1递增到+7 | |
| B. | 在周期表中的过渡元素中寻找半导体材料 | |
| C. | 元素周期表中元素的性质与元素在周期表中的位置有关 | |
| D. | 同种元素的原子均有相同的质子数和中子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子交换膜在工业上应用广泛,在氯碱工业中使用阳离子交换膜 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是防止食品氧化变质 | |
| C. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| D. | 压缩天然气(CNG)、水煤气的主要成分是烃类,是城市推广的清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
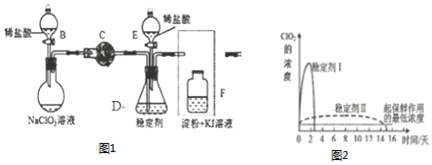
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
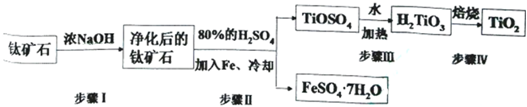
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 室温下,向苯酚钠溶液中通入足量CO2,溶液变浑浊. | 碳酸的酸性比苯酚的强 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(Ba2S O4)<Ksp(Ca2S O4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe2+的氧化性比I2的强 |
| D | 室温下,用PH试纸测得:0.1mol•L-1 Na2SO3溶液的PH约为10;0.1mol•L-1 NaHSO3溶液的PH约为5. | HSO3-结合H+的能力比SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com