
| c(H+)?c(HCO3-) |
| c(H2CO3) |
| c(H+)?c(HCO3-) |
| c(H2CO3) |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
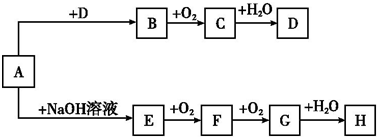
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
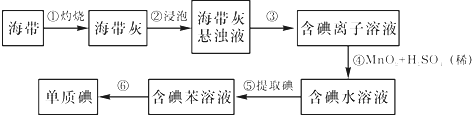
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 1、向试管中加锌粒 | 2、对量筒中液体读数 | 3、稀释浓H2SO4 |
| 错误操作 |  |  | 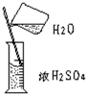 |
| 不良后果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应产生的各种能量是人类探索太空所需能量的重要来源.
化学反应产生的各种能量是人类探索太空所需能量的重要来源.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①⑤ |
| C、②③④ | D、②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com