
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
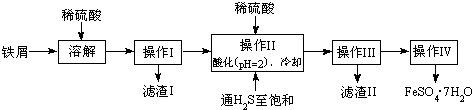
分析 本题是工业制备绿矾的流程探究,涉及反应原理,用稀硫酸溶解铁和氧化铁的混合物,并通H2S利用沉淀法可除去其中混有的Sn2+,考虑到Fe2+易水解和易氧化,因此要保持溶液处于酸环境同时铁粉过量,对所得硫酸亚铁溶液可以通过蒸发浓缩并冷却结晶的方法得到,经过洗涤干燥后再通过滴定法测定样品的纯度;
(1)Fe和Fe2O3在硫酸溶液中发生的反应包括铁和氧化铁与稀硫酸的反应及多余的铁将三价铁还原成二价铁;
(2)依据流程关系图分析,通入硫化氢制饱和,硫化氢是强还原剂,目的是沉淀锡离子,防止亚铁离子被氧化;在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(3)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(4)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(5)常温下Ksp[Fe(OH)2]=1.64×10-14=c(Fe2+)×c2(OH-),Fe2++2H2O?Fe(OH)2+2H+的平衡常数K=$\frac{{c}^{2}({H}^{+})}{c(F{e}^{2+})}$,再结合Kw进行计算;
(6)依据滴定实验的反应终点时发生的反应根据关系式进行计算.
解答 解:(1)铁与稀硫酸反应的离子方程式为Fe+2H+=Fe2++H2↑,氧化铁溶解在稀硫酸中的离子反应式为Fe2O3+6H+=2Fe3++3H2O,Fe3+继续溶解铁的离子反应式为2Fe3++Fe=3Fe2+,故答案为:Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+;
(2)通入硫化氢至饱和除沉淀Sn2+外,因硫化氢具有强还原性,可以防止亚铁离子被氧化,已知在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,故答案为:防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,故答案为:蒸发浓缩、冷却结晶;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(5)Fe2++2H2O?Fe(OH)2+2H+的平衡常数K=$\frac{{c}^{2}({H}^{+})}{c(F{e}^{2+})}$=$\frac{{c}^{2}({H}^{+})×{c}^{2}(O{H}^{-)}}{c(F{e}^{2+})×{c}^{2}(O{H}^{-})}=\frac{{K}_{w}}{{K}_{sp}[Fe(OH)_{2}]}$=$\frac{(1×1{0}^{-14})^{2}}{1.64×1{0}^{-14}}$=0.6×10-14,故答案为:0.6×10-14;
(6)a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL,则
5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×$\frac{250}{25}$=0.01mol;
FeSO4•7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=$\frac{2.78g}{2.85g}$×100%=97.5%,
故答案为:97.5%.
点评 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中,共价键的键能越大,熔沸点越低 | |
| B. | 分子晶体中,分子间作用力越大,该分子越稳定 | |
| C. | 金属阳离子只能与阴离子构成晶体 | |
| D. | 甲烷分子中,键角为109.5° |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②③⑤⑥ | C. | ②④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在1L 2 mol/L的硝酸钙溶液中含有的硝酸根离子的数目为NA | |
| B. | 标准状况下22.4L乙醇完全燃烧,生成的二氧化碳的分子数为2NA | |
| C. | 46g二氧化氮(NO2)和46g四氧化二氮(N2O4)含有的原子数均为3NA | |
| D. | 1mol氢氧根离子中含有的电子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①图中每个小三角形的三种物质中至少含有一种相同元素,H与I含有完全相同的元素.②A、J为固体单质,D为气体单质,其余物质为常见化合物.③B为淡黄色化合物,B与H反应能生成D.④E为常见金属氧化物.⑤F的溶液和H反应生成白色胶状沉淀G.
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,H与I含有完全相同的元素.②A、J为固体单质,D为气体单质,其余物质为常见化合物.③B为淡黄色化合物,B与H反应能生成D.④E为常见金属氧化物.⑤F的溶液和H反应生成白色胶状沉淀G. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com