
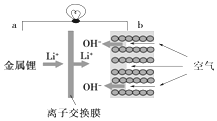
| A. | a为电源正极 | B. | 电流从a流向b | ||
| C. | 离子交换膜为阳离子交换膜 | D. | b电极处,O2失电子生成OH- |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Al3++3NH4++6OH-=Al(OH)3↓+3NH3•H2O | |
| B. | 2Al3++NH4++7OH-=2Al(OH)3↓+NH3•H2O | |
| C. | Al3++3NH4++7OH-=AlO2-+3NH3•H2O+2H2O | |
| D. | Al3++5NH4++9OH-=AlO2-+5NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
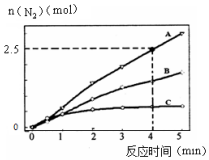 I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.| 温度/K | 反应① | 反应② | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com