
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
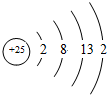
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);分析 (1)Mn原子核外有4个电子层,K、L、M、L电子层上电子数分别是2、8、13、2;原子轨道中电子处于全满、全空、半满上最稳定;
(2)①含有空轨道和含有孤电子对的原子之间易形成配位键,铁原子含有空轨道;
②根据价层电子对互斥理论确定原子杂化方式;
原子个数相等、价电子数相等的微粒互为等电子体;
(3)分子晶体熔沸点较低;
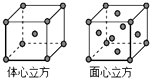
(4)体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,面心立方晶胞中Fe原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4;
(5)该晶胞中总铁原子体积=2×$\frac{4}{3}$πr3,晶胞边长a=$\sqrt{\frac{16}{3}}$r,体心立方晶胞中晶体体积a3=($\sqrt{\frac{16}{3}}$r)3,
晶胞空间利用率=$\frac{铁原子总体积}{晶胞体积}×100%$.
解答 解:(1)Mn原子核外有4个电子层,K、L、M、L电子层上电子数分别是2、8、13、2,所以其原子结构示意图为 ;原子轨道中电子处于全满、全空、半满上最稳定,
;原子轨道中电子处于全满、全空、半满上最稳定,
由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态),
故答案为: ;由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
;由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
(2)①含有空轨道和含有孤电子对的原子之间易形成配位键,铁原子含有空轨道,所以配原子或配离子应该有孤对电子,故答案为:有孤对电子;
②配体CN-中C原子价层电子对个数是2且不含孤电子对,所以C原子采用sp杂化;原子个数相等、价电子数相等的微粒互为等电子体,所以与配体CN-互为等电子体的分子是氮气,其结构式为N≡N,故答案为:sp;N≡N;
(3)分子晶体熔沸点较低,该物质的熔沸点较低,所以为分子晶体,故答案为:分子晶体;
(4)体心立方晶胞中Fe原子个数=1+8×$\frac{1}{8}$=2,面心立方晶胞中Fe原子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,所以体心立方和面心立方晶胞中Fe原子个数之比=2:4=1:2,故答案为:1:2;
(5)该晶胞中总铁原子体积=2×$\frac{4}{3}$πr3,晶胞边长a=$\sqrt{\frac{16}{3}}$r,体心立方晶胞中晶体体积a3=($\sqrt{\frac{16}{3}}$r)3,
晶胞空间利用率=$\frac{铁原子总体积}{晶胞体积}×100%$=$\frac{2×\frac{4}{3}×π×{r}^{3}}{(\sqrt{\frac{16}{3}}r)^{3}}$×100%=68%,
故答案为:68%.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、原子核外电子排布等知识点,难点是晶胞计算,注意体心立方中体对角线上三个原子紧贴、面心立方晶胞中同一面上对角线上三个原子紧贴,为易错点.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题

| A. | t1时,只有正方向反应 | B. | t1~t2,X2的物质的量越来越多 | ||
| C. | t2~t3,反应不再发生 | D. | t2~t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、C
、C .
. .
.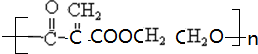 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉花和蛋白质都是高分子化合物,水解产物相同 | |
| B. | 苯和己烯都能使溴水褪色,均与溴水发生加成反应 | |
| C. | 可用碳酸氢钠溶液鉴别乙酸和乙醇 | |
| D. | 用溴水除去甲烷中混有的少量乙烷气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:W>Z>Y>X | |
| B. | W单质易溶于化合物YW2 | |
| C. | 氢化物的稳定性和沸点均是Z>W | |
| D. | X单质在加热的条件下与Z的某种单质反应生成X2Z2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔和苯酚 | B. | 乙醇和乙酸 | C. | 甲醛和葡萄糖 | D. | 丙烯和丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和脂肪,苯和汽油 | |
| B. | 油脂和水,溴苯和水,硝基苯和水 | |
| C. | 甲醛和水,蚁酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,鸡蛋白和水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com