
硼酸(H3BO3)与铝酸(H3AlO3)结构相似,可写成B(OH)3。
(1)已知H3BO3的电离常数为5.8×10﹣10,H2CO3的电离常数为Ka1=4.4×10﹣7、Ka2=4.7×10﹣11。向盛有饱和硼酸溶液的试管中,滴加0.1mol/L Na2CO3溶液, (填“能”或“不能”)观察到气泡逸出。
(2)已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH﹣=B(OH)4﹣,写出硼酸的电离方程式 ,它是 元酸。(填“一”或“二”或“三”)
(3)硼酸和甲醇在浓硫酸存在下生成B(OCH3)3,B(OCH3)3可与NaH反应制得易溶于水的强还原剂硼氢化钠(NaBH4)。①NaBH4中氢元素的化合价为 ,写出生成NaBH4的化学方程式 。
②写出生成B(OCH3)3的化学方程式 。
③用NaBH4和过氧化氢可以设计成一种新型碱性电池。该电池放电时,每摩尔NaBH4释放8mole﹣。写出这种电池放电反应的离子方程式 。
(4)H3BO3可以通过电解的方法制备。工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。

①写出阳极的电极反应式 。
②分析产品室可得到H3BO3的原因 。
(5)过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热会逐步失去结晶水。 实验测得过硼酸钠晶体的质量随温度变化的情况如下图所示,则T2℃时所得晶体的化学式为 。

科目:高中化学 来源:2015-2016学年江西省高二上12月月考化学试卷(解析版) 题型:填空题
二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____ _____.
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=﹣41.3kJ•mol﹣1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g) △H=___________;则该反应( )
A.任何温度下都能进行
B.任何温度下都不能进行
C.高温下能自发进行
D.低温下能自发进行
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(以上都填字母代号).
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g)═CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol•L﹣1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v正__________ v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=__________.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上12月月考化学试卷(解析版) 题型:选择题
在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A.Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2==2NO2
B.进一步反应对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
C.Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
D.针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:选择题
一定温度下,某密闭容器中的反应为:aX(g)+bY(g)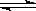 cZ(g)+dW(g),经5min达到平衡,X减少n mol/L,Y减少n/3mol/L,Z增加2n/3mol/L。若将体系压强增大,W的百分含量不发生变化,则
cZ(g)+dW(g),经5min达到平衡,X减少n mol/L,Y减少n/3mol/L,Z增加2n/3mol/L。若将体系压强增大,W的百分含量不发生变化,则 为
为
A.3:1:2:1 B.1:3:2:2 C.1:3:1:2 D.3:1:2:2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏唐徕回民中学高二上10月月考化学卷(解析版) 题型:选择题
已知:在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气,放出484kJ热量。下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016届广西河池市高三上第五次月考理综化学试卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
B | 在KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变成蓝色 | KIO3的氧化性比I2强 |
C | 向CH2=CHCH2OH中滴入酸性高锰酸钾溶液 | 紫红色褪去 | 证明CH2=CHCH2OH中含有碳碳双键 |
D | 向Na2S溶液中加入酚酞,再滴加稀盐酸 | 溶液先变红,后红色变浅直至消失 | 证明非金属性:Cl>S |
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量不可能为5 g
B.参加反应的硝酸的物质的量为0.1 mol
C.沉淀完全时消耗NaOH溶液的体积为150 mL
D.溶解合金时收集到NO气体的体积在标准状况下约为2.24 L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
对于反应4CO(g)+2NO2(g)  N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
N2(g)+4CO2(g),以下化学反应速率的表示中,所表示反应速率最快的是
A.v(CO)=1.6 mol·(L·min) -1 B.v(NO2)=0.9 mol·(L·min) -1
C.v(N2)=0.25mol·(L·min) -1 D.v(CO2)=1.2 mol·(L·min) -1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com