
分析 1mol烃CxHy的耗氧量为(x+$\frac{y}{4}$)mol,据此计算消耗氧气的量;等质量的各烃,烃中H元素质量分数越大,消耗氧气越大,据此进行解答.
解答 解:(1)1molCxHy的耗氧量为(x+$\frac{y}{4}$)mol,由各烃分子式中C、H原子数目可知,相同物质的量各烃C4H10的耗氧量最大,故答案为:C4H10;
(2)等质量的各烃,烃中H元素质量分数越大,消耗氧气越大,C元素质量分数越大,生成二氧化碳越多,CH4、C2H6、C2H2、C4H10的C、H原子数目之比分别为1:4、1:3、1:1、1:2.5,故CH4中氢元素质量分数最大,等质量的各烃中CH4消耗氧气最多,故答案为:CH4.
点评 本题考查有机物分子式确定的计算,题目难度中等,注意根据燃烧通式及质量分数理解耗氧量问题,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 溶液的质量相等 | |
| B. | 每升溶液中溶质的质量相等 | |
| C. | 相同体积的溶液,其溶质的物质的量相等 | |
| D. | 每升溶液中溶质的微粒数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
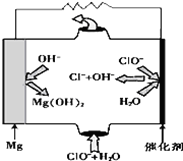 镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )
镁--次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO-+H2O+2e-═Cl-+2OH-,关于该电池的叙述正确的是( )| A. | 该电池中镁为负极,发生还原反应 | |
| B. | 该电池的总反应为:Mg+ClO-+H2O═Mg(OH)2↓+Cl- | |
| C. | 电池工作时,正极周围溶液的碱性将不断减弱 | |
| D. | 电池工作时,OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氡是双原子分子 | |
| B. | 氡气因其化学性质活泼而对人体有害 | |
| C. | 氡气因其具有放射性而对人体有害 | |
| D. | 222Rn、219Rn、220Rn互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
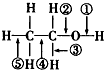
| A. | 在银催化条件下与O2反应时断裂①和③ | |
| B. | 乙醇燃烧是断裂②和⑤ | |
| C. | 和金属钠反应时①断裂 | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
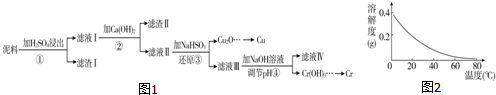
| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③⑤ | B. | 只有④⑤ | C. | ①②③④⑤ | D. | 只有①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a L | B. | $\frac{a}{2}$ L | C. | $\frac{a}{3}$ L | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com