
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧原子的结构示意图: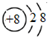 | |
| C. | 水分子的电子式: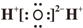 | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
分析 A.质量数=质子数+中子数,元素符号的左上角为质量数,左下角为质子数;
B.氧原子的核电荷数=核外电子总数=8,最外层含有6个电子;
C.水分子为共价化合物,不存在阴阳离子;
D.HCOOC2H5为甲酸乙酯,乙酸甲酯为乙酸和甲醇生成的酯.
解答 解:A.质子数为8、中子数为10的氧原子的质量数为18,该原子可以表示为:${\;}_{8}^{18}$O,故A正确;
B.氧原子的最外层含有6个电子,其正确的原子结构示意图为: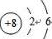 ,故B错误;
,故B错误;
C.水为共价化合物,其分子中含有2个O-H键,水的电子式为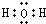 ,故C错误;
,故C错误;
D.乙酸甲酯是乙酸和甲醇发生酯化反应生成的酯,则乙酸甲酯的结构简式为:CH3COOCH3,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、原子结构示意图、元素符号、结构简式等知识,明确常见化学用语的表示方法为解答关键,试题培养了学生的规范答题能力.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题:
已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题: .画出G离子的结构示意图
.画出G离子的结构示意图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.05g | B. | 5.4 g | C. | 2.7g | D. | 8.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C将Fe3+还原为Fe2+ | D. | 亚硝酸盐被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水吸收少量的CO2气体:NH3•H2O+CO2═NH4++HCO3- | |
| B. | Na2SO3溶液中SO32-的水解:SO32-+2H2O═H2SO3+2OH- | |
| C. | KClO3溶液与浓盐酸反应:ClO3-+5Cl-+6H+═3Cl2↑+3H2O | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH反应:Fe2++2OH-═Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在处理废水的过程中,pH升高 | |
| B. | 铁做负极,电极反应式是 Fe-2e-═Fe2+ | |
| C. | 处理、净化过程中发生的反应都是氧化还原反应 | |
| D. | Fe(OH)3胶体,可净化除去废水中的悬浮物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com