
【题目】汽车尾气中通常含有NxOy和CO等大气污染物,科学家寻找高效催化剂实现了汽车尾气的转化进而减少汽车尾气对大气的污染。
(1)己知:①CO的燃烧热△H1=-283kJ·mol-1 ②N2(g)+O2(g) =2NO(g) △H2 =+183kJ·mol-1
由此写出NO和CO反应的热化学反应方程式________________________________。
(2)一定温度下,向2L密闭容器中充入4.0mo1NO2和4.0molCO,在催化剂作用下发生反应 4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
0 min | 5 min | 10 min | 15 min | 20 min | |
c(NO2)/ mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
C(N2)/ mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①5l0min,用N2的浓度变化表示的反应速率为__________________。
②以下表述能说明该反应己达到平衡状态的是________。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡 ______________(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= __________ (保留两位有效数字)。
(3)CO、空气与过量KOH溶液可构成燃料电池(石墨为电极):
①写出该电池的负极反应式____________________________;
②常温下,用该燃料电池电解(惰性电极)1L饱和食盐水(足量),当两极共生成4.48L (折算为标准状况)气体时电解池溶液的pH=__________。(忽略溶液的体积变化,己知1g2=0.3,lg5=0.7)
【答案】 2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H=-749 kJ·moL-1 0.014 mol·L-1·min-1 A、C 增大 0.11 CO-2e-+4OH-=CO32-+2H2O 13.3
N2(g)+2CO2(g) △H=-749 kJ·moL-1 0.014 mol·L-1·min-1 A、C 增大 0.11 CO-2e-+4OH-=CO32-+2H2O 13.3
【解析】(1)己知:CO的燃烧热△H1=-283kJ·mol-1,则
①2CO(g)+O2(g)![]() 2CO2(g)△H1=-566kJ·moL-1
2CO2(g)△H1=-566kJ·moL-1
②N2(g)+O2(g)=2NO(g)△H2=+183kJ·mol-1
根据盖斯定律可知①-②即得到NO和CO反应的热化学反应方程式为2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=-749 kJ·moL-1。
N2(g)+2CO2(g)△H=-749 kJ·moL-1。
(2)①根据表中数据可知5l0min内氮气浓度的变化量为0.22mol/L-0.15mol/L=0.07mol/L,因此用N2的浓度变化表示的反应速率为0.07mol/L÷5min=0.014 mol·L-1·min-1。②A.气体颜色不再变化说明NO2浓度不再发生变化,反应达到平衡状态,A正确;B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此气体密度不再变化不能说明反应达到平衡状态,B错误;C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以气体平均相对分子质量不再变化说明反应达到平衡状态,C正确,答案选AC;③20 min时,保持温度不变,继续向容器中加入1.0mol NO2和1.0molCO,相当于增大压强,在t1时刻反应再次达到平衡,则NO2的转化率比原平衡增大。④根据方程式可知
4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g)
N2(g)+4CO2(g)
起始浓度(mol/L) 2 2 0 0
转化浓度(mol/L) 1 0.5 0.25 1
平衡浓度(mol/L) 1 1.5 0.25 1
所以该温度下反应的化学平衡常数K=![]() 。
。
(3)①CO在负极通入,发生失去电子的氧化反应,电解质溶液是KOH,所以该电池的负极反应式为CO-2e-+4OH-=CO32-+2H2O;②气体的物质的量是0.2mol,因此氢气和氯气均是0.1mol,则生成氢氧化钠是0.2mol,浓度是0.2mol/L,所以氢离子浓度是![]() ,则电解池溶液的pH=14-lg5=13.3。
,则电解池溶液的pH=14-lg5=13.3。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1mol任何气体的体积都是22.4L
B. 同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C. 在标准状况下,体积为22.4L的物质都是1mol
D. 在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是( )
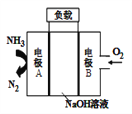
A. 电流由电极A经外电路流向电极B
B. 电池工作时,OH-向电极B移动
C. 该电池工作时,每消耗22.4L NH3转移3mol电子
D. 电极A上发生的电极反应为:2NH3-6e-+ 6OH-=N2 + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )
A. ![]() 、
、![]() B. AgCl、
B. AgCl、![]()
C. ![]() 、
、![]() D.
D. ![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①氢氧化钡固体 ②KHSO4 ③HNO3 ④稀硫酸 ⑤二氧化碳气体 ⑥铜 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠 ⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是____________________________________。
(2)属于电解质的是__________________________________________。
(3)属于非电解质的是____________________________________。
(4)②在水溶液中的电离方程式为_____________________,①与②在溶液中反应使溶液呈中性的离子方程式为______________________________________________。
(5)③与⑥可以发生如下反应:Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
I.还原产物是________。
II.当有2 mol HNO3参加反应时,被氧化的物质的质量为________g。
Ⅲ.用单线桥法标出反应中电子转移的方向和数目________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
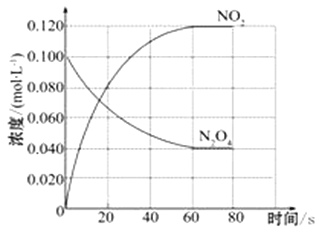
回答下列问题:
(1)反应的△H___________0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为_____________molL-1s-1,反应的平衡常数K1为______________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10 s又达到平衡。
① T __________100℃(填“大于”“小于”),判断理由是______________________________________;
② 温度T时反应的平衡常数K2 为 ___________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方案正确的是( )
A.氢氧化钠溶液中混有氢氧化钡(硫酸铜溶液)
B.二氧化碳气体中混有氯化氢(氢氧化钠溶液)
C.硝酸铜溶液中混有硝酸银(铜粉)
D.氧化钙中混有碳酸钠(稀盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C. NaHSO4溶液与Ba(OH)2溶液混合后呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D. 二氧化锰和浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com