
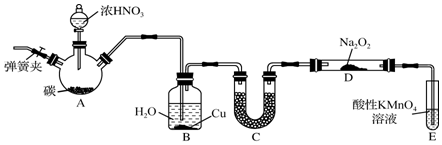
分析 Ⅰ.制备NaNO2并对其性质作探究,由实验装置可知,A中发生C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,B中稀释挥发的硝酸和生成的二氧化氮,C中固体干燥剂干燥NO,并除去可能混有的酸雾,D中发生2NO+Na2O2═2NaNO2,E中高锰酸钾吸收尾气NO,
(1)A中是碳和浓硝酸发生的反应生成二氧化碳、二氧化氮和水;
(2)B中稀释挥发的硝酸和生成的二氧化氮,使二氧化氮转化为NO,同时稀硝酸和铜发生反应;
(3)保证气体中酸性气体吸收,一氧化氮气体干燥;
(4)E装置的作用是吸收有毒的NO气体,避免污染空气;
II.测定NaNO2纯度
(5)将NaNO2滴加到酸性高锰酸钾溶液中,可观察到紫色溶液颜色变浅,直至褪色,说明二者发生氧化还原反应,亚硝酸根离子被氧化生成硝酸根离子,高锰酸根离子被还原生成锰离子,结合化学反应的定量关系计算;
解答 解:(1)装置A三颈烧瓶中发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)B装置的目的是①将NO2转化为NO、②铜与稀硝酸反应生成NO,故答案为:将NO2转化为NO;铜与稀硝酸反应生成NO;
(3)A、C不能吸收酸,B、D可吸收酸且干燥气体,故答案为:BD;
(4)由信息可知,E装置的作用是利用高锰酸钾溶液的强氧化性氧化吸收有毒气体一氧化氮,吸收有毒的NO气体,避免污染空气,反应的离子方程式为:5NO+3MnO4-+4H+=5NO3-+3 Mn2++2H20,
故答案为:5NO+3MnO4-+4H+=5NO3-+3 Mn2++2H20;
(5)将NaNO2滴加到酸性高锰酸钾溶液中,可观察到紫色溶液颜色变浅,直至褪色,说明二者发生氧化还原反应,亚硝酸根离子被氧化生成硝酸根离子,高锰酸根离子被还原生成锰离子,将NaNO2滴加到酸性高锰酸钾溶液中,可观察到紫色溶液颜色变浅,直至褪色,说明二者发生氧化还原反应,亚硝酸根离子被氧化生成硝酸根离子,高锰酸根离子被还原生成锰离子,离子方程式为,准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解.用a mol•L-1酸性KMnO4溶液滴定,达滴定终点时所用KMnO4溶液体积为bml.
2MnO4-+5NO2-+6H+=2Mn 2++3H2O+5NO3-,
2 5
amol/L×b×10-3L n
n=$\frac{5a×b×1{0}^{-3}}{2}$mol
则样品中NaNO2的质量分数为$\frac{\frac{5a×b×1{0}^{-3}}{2}mol×69g/mol}{mg}$×100%=$\frac{69ab}{4m}%$,
故答案为:$\frac{69ab}{4m}%$;
点评 本题考查物质的制备实验,为高频考点,把握制备实验原理、实验装置的作用、氧化还原反应的应用为解答的关键,侧重分析与实验及应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 碘酒 | 分散系 | 混合物 |
| B | 液氯 | 电解质 | 化合物 |
| C | 硫酸钠 | 盐 | 纯净物 |
| D | NaHSO4 | 酸式盐 | 电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
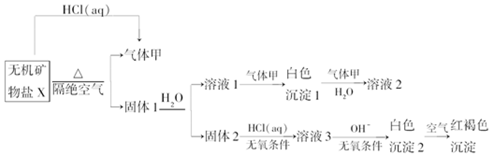
 ,写出气体甲的电子式
,写出气体甲的电子式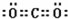 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量HNO3溶液,产生白色沉淀,溶液中一定含有大量SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的CO32-
C.加入足量浓 NaOH溶液,产生带有强烈刺激性气味的气体,溶液中一定含有大量NH4+
D.先加适量盐酸将溶液酸化,再加AgNO3溶液,产生白色沉淀,溶液中一定含有大量Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com