
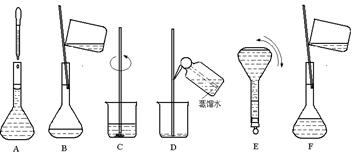
| 实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为 克 |
| ②称量Na2SO4固体 | |
| ③将Na2SO4加入100mL烧杯中,并加入适量水溶解 | |
| ④将烧杯中溶液转移至500mL容量瓶中 | 为了防止溶液溅出,应采取什么措施: |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1—2厘米处应如何操作: |
| ⑥摇匀 | |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.32g O2中含有的分子数为NA |
| B.标准状况下,22.4 L H2O中含有的分子数为NA |
| C.1 mol Mg与足量O2反应转移的电子数为NA |
| D.1 L 1 mol·L-1 CaCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个 |
| B. 0.1molOH-含NA个电子 |
| C.1.8g重水(D2O)中含NA个中子 |
| D.标准状况下11.2L臭氧中含NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.该硫酸的物质的量浓度为9.2 mol/L |
| B.该浓硫酸中溶质、溶剂分子数目之比为9:1 |
| C.在盛放该药品的标签上应标出如图二所示的警示标记 |
| D.该硫酸与等质量的水混合所得溶液的物质的量浓度等于9.2 mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.7:1 | B.1:7 | C.7:8 | D.8:7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,23g NO2含有nA个氧原子 |
| B.1L0.1mol?L-1的氨水含有0.1nA个OH― |
| C.常温常压下,22.4LCCl4含有nA个CCl4分子 |
| D.1molFe2+与足量的H2O2溶液反应,转移2nA个电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com