
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
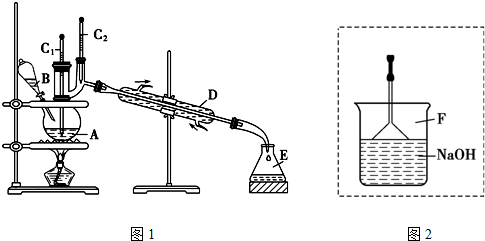
分析 实验室合成溴苯是苯与液溴在铁粉作催化剂的条件下发生取代反应生成溴苯和溴化氢;反应方程式为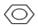 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr,苯与液溴反应生成HBr,苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,用F倒扣漏斗防止倒吸,该实验方案证明苯和溴发生的是取代反应而不是加成反应不合理,因溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀.
+HBr,苯与液溴反应生成HBr,苯的卤代反应是放热反应,液溴易挥发,所以尾气中有HBr及挥发出的Br2,用氢氧化钠溶液吸收,防止污染大气,用F倒扣漏斗防止倒吸,该实验方案证明苯和溴发生的是取代反应而不是加成反应不合理,因溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀.
①根据制取溴苯所加的液体的体积以及溶液的体积一般不超容器的$\frac{2}{3}$,不少于$\frac{1}{3}$来解答,根据反应物的体积,则可用100mL的烧瓶;
②应根据蒸气的温度确定收集馏分;
③苯和溴发生取代反应生成溴化氢,苯、溴和溴化氢都易挥发;
④溴可与氢氧化钠反应生成溴化钠,与硝酸银反应生成溴化银沉淀.
解答 解:①操作过程中,先在A中加入30.0mL无水苯和少量铁屑.在B中小心加入8.0mL液态溴,共约38mL,蒸馏时,制取溴苯所加的液体的体积以及溶液的体积一般不超容器的$\frac{2}{3}$,不少于$\frac{1}{3}$,则可用100mL的烧瓶,
故选:c;
②C2用于测量溴苯的温度,由溴苯的沸点可知,所显示的温度为156℃,
故答案为:C2;156℃;
③苯和溴发生取代反应生成溴化氢,苯、溴和溴化氢都易挥发,则在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有溴、溴化氢、苯,
故答案为:Br2、HBr、C6H6;
④溴可与氢氧化钠反应生成溴化钠,与硝酸银反应生成溴化银沉淀,如检验是否生成溴化氢,应先通过苯除去溴,该实验原理不合理,
故答案为:不合理;溴可以和NaOH溶液反应生成溴离子,也能产生浅黄色沉淀,无法确定是否生成溴化氢,即无法确定两者发生的是取代反应.
点评 本题主要考查溴苯的制备,侧重于学生的分析能力、实验能力和元素化合物知识的综合理解和运用的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 若W为有颜色的物质,达平衡后,增大压强,体系颜色变浅 | |
| B. | 改变压强,该反应的平衡常数不变 | |
| C. | 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小 | |
| D. | 平衡时,其他条件不变,分离出 Z,正反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②③④ | C. | ①②③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
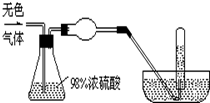 有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:
有一无色气体(可能由O2、N2、CO2、HCl、NH3、H2、NO、NO2中的一种或几种组成),体积为100mL.如图示通过浓硫酸的洗气瓶,发现气体体积减少到一半;通过球形干燥管后气体呈红棕色,再将该气体完全通入盛满水且倒立于水槽的试管内,发现倒立于水槽的试管内的水位下降后又缓慢上升,最后试管内全部充满液体,由此判断:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com