


科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| T | T原子所处的周期数、族序数分别与其原子序数相等 |
| X | X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z | Z可形成Z2、Z3两种气态单质 |
| Q | 在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R | 3p能级上有1个电子 |
| W | W的一种核素的质量数为56,中子数为30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-═Al(OH)3 |
| B、以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、测0.1mol/L氨水的pH为11:NH3?H2O?NH4++OH- |
| D、钢铁发生吸氧腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学家可以制造出自然界中不存在的物质 |
| B、化学研究的主要目的就是认识分子 |
| C、化学科学与其他科学分支的联系不密切 |
| D、化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X:3d64s2 Y:2s22p4 |
| B、X:2s22p3Y:2s22p4 |
| C、X:3s23p1Y:3s23p4 |
| D、X:3s2Y:3s23p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2③3s23p3 ④3s23p4 第一电离能最大的是③ |
| C、①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ |
| D、某元素气态基态原子的逐级电离能(kJ?mol-1)分别为738、1 451、7 733、10 540、13 630、17 995、21 703,当它与氯气反应时可能生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
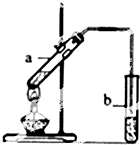 实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.
实验题:“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用如图所示装置制取乙酸乙酯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com