
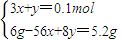 ,
,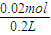 =0.1mol/L,
=0.1mol/L,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:0114 月考题 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.在氢氧化钡溶液中加入过量的小苏打:
Ba2++OH—+HCO3—=BaCO3↓十H2O
B.在硫酸氢钠溶液中加入氢氧化钡溶液至pH=7
Ba2++2OH—+2H++SO42—=BaSO4↓十2H2O
C.将5.6克铁粉加入80毫升0.5摩/升的硝酸溶液中
3Fe+8H++2NO3—=3Fe2++4H2O+2NO↑
D.在碘化亚铁溶液中滴入少量氯水:
2Fe2++4I—+3Cl?2=2Fe3++6Cl—+2I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com