
����Ŀ���״�����Ϊȼ�ϵ�ص�ԭ�ϡ�CO2��CO����Ϊ��ҵ�ϳɼ״���CH3OH����ֱ��̼Դ��
��1����֪�ڳ��³�ѹ�£�
��CH3OH��l��+ O2��g��=CO��g�� + 2H2O��g���� ��H����355.0 kJ�Mmol
��2CO��g��+ O2��g��= 2CO2��g�� ��H����566.0 kJ/mol
��H2O��l��=H2O��g�� ��H��+44.0 kJ/mol
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ��___________________________
��2������CO��H2��һ�������¿ɺϳɼ״����������·�Ӧ��CO��g����2H2��g��=CH3OH��g���������ַ�Ӧ�����������ı仯��������ͼa��b��ʾ������˵����ȷ����__________
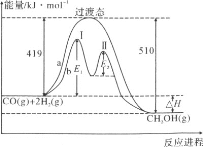
A��������Ӧ����H����91kJ��mol��1
B��a��Ӧ����Ӧ�Ļ��Ϊ510kJ��mol��1
C��b�����еڢ��Ϊ���ȷ�Ӧ���ڢ��Ϊ���ȷ�Ӧ
D��b����ʹ�ô������˷�Ӧ�Ļ�ܺ���H
E��b���̵ķ�Ӧ���ʣ��ڢ�Σ��ڢ��
��3�������ǿ���С����Ƶ�һ���״�ȼ�ϵ�أ����ߵ���Ӱ����Ϊa��b���Ե缫���ֱ��õ������ձ���m��n�����ӣ�����ԭ��ʾ��ͼ��ͼ��
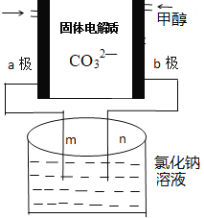
��b���缫��ӦʽΪ____________��
���ڱ�״���£���ͨ��112mL��O2���������ձ��е���Һ�����Ϊ200mL��������䣩���Ӧ��ֹʱ�ձ�����Һ��pHΪ______��
��4��������CO2���ݵ绯ѧԭ���Ʊ����ϣ��ȼ��ٹ�ҵ��������ϩ���������ִﵽ����CO2�ŷŵ�Ŀ�ġ�������������ĤΪ�����缫��ϡ����Ϊ�������Һ����һ��������ͨ��CO2���е�⣬���������Ƶõ��ܶȾ���ϩ![]() �����LDPE����
�����LDPE����
�ٵ��ʱ�������ĵ缫��Ӧʽ��________��
�ڹ�ҵ������1.4��102kg��LDPE����������Ҫ��״����________L��CO2��
���𰸡�CH3OH��l����![]() O2��g�� ===CO2��g����2H2O��l�� ��H����726.0 kJ/mol ACE CH3OH -6e-+3 CO32��== 4 CO2��2H2O 13 2n CO2 + 12nH+ + 12n e�� ==
O2��g�� ===CO2��g����2H2O��l�� ��H����726.0 kJ/mol ACE CH3OH -6e-+3 CO32��== 4 CO2��2H2O 13 2n CO2 + 12nH+ + 12n e�� == ![]() + 4n H2O 2.24��105
+ 4n H2O 2.24��105
��������
(1)��֪�ڳ��³�ѹ�£���CH3OH(l)+ O2(g)=CO(g) + 2H2O(g)�� ��H����355.0 kJ�Mmol����2CO(g)+ O2(g)= 2CO2(g) ��H����566.0 kJ/mol����H2O(l)=H2O(g) ��H��+44.0 kJ/mol���ɸ�˹���ɿ�֪����+����![]() - ����2��CH3OH(l)��
- ����2��CH3OH(l)��![]() O2(g) ===CO2(g)��2H2O(l)���ɴ˼�����H��
O2(g) ===CO2(g)��2H2O(l)���ɴ˼�����H��
(2)A�����������仯ͼ��������Ӧ���ʱ���H=����Ӧ���-�淴Ӧ��ܣ�
B��a��Ӧ����Ӧ�Ļ��Ϊ419KJ/mol��
C��ͼ�����߱仯�������仯��֪b�����еڢ��Ϊ���ȷ�Ӧ���ڢ��Ϊ���ȷ�Ӧ��
D����������ı䷴Ӧ���̣������ı䷴Ӧ����ЧӦ��
E��b���̵ķ�Ӧ����ȡ���ڷ�Ӧ��ܵĴ�С�����Խ��Ӧ����ԽС��
(3)�ٵõ��ӷ�����ԭ��Ӧ�ĵ缫Ϊ������ʧ���ӷ���������Ӧ�ĵ缫Ϊ������b�缫�ϼ״�ʧ���ӷ���������Ӧ��
�ڸ���ͼ֪��aΪ������bΪ����������Ȼ�����Һʱ��mΪ������nΪ���������ݵ��ط�Ӧʽ2NaCl+2H2O![]() H2��+Cl2+2NaOH������غ㷨���㣻
H2��+Cl2+2NaOH������غ㷨���㣻
(4)��2nCO2��![]() ��̼�Ļ��ϼ۴�+4��Ϊ-2��ÿ��Cԭ�ӵõ�6�����ӣ���2nCO2�ܹ��õ�12n�����ӣ����ݵ���غ���д�õ缫��Ӧʽ��
��̼�Ļ��ϼ۴�+4��Ϊ-2��ÿ��Cԭ�ӵõ�6�����ӣ���2nCO2�ܹ��õ�12n�����ӣ����ݵ���غ���д�õ缫��Ӧʽ��
�ڹ�ҵ������1.4��104kg��LDPE������2nCO2��![]() �������Ҫ������̼�����ʵ�����Ȼ�����V=nVm�������Ҫ����¶�����̼�������
�������Ҫ������̼�����ʵ�����Ȼ�����V=nVm�������Ҫ����¶�����̼�������
(1)��֪�ڳ��³�ѹ�£���CH3OH(l)+ O2(g)=CO(g) + 2H2O(g)�� ��H����355.0 kJ�Mmol����2CO(g)+ O2(g)= 2CO2(g) ��H����566.0 kJ/mol����H2O(l)=H2O(g) ��H��+44.0 kJ/mol���ɸ�˹���ɿ�֪����+����![]() - ����2��CH3OH(l)��
- ����2��CH3OH(l)��![]() O2(g) ===CO2(g)��2H2O(l)������H=(��355.0 kJ�Mmol)+(��566.0 kJ/mol)��
O2(g) ===CO2(g)��2H2O(l)������H=(��355.0 kJ�Mmol)+(��566.0 kJ/mol)��![]() - (+44.0 kJ/mol)��2=��726.0 kJ/mol���״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)��
- (+44.0 kJ/mol)��2=��726.0 kJ/mol���״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)��![]() O2(g) ===CO2(g)��2H2O(l) ��H����726.0 kJ/mol��
O2(g) ===CO2(g)��2H2O(l) ��H����726.0 kJ/mol��
(2)A��������Ӧ����H=(419-510)kJmol-1=-91kJmol-1����A��ȷ��
B��a��Ӧ����Ӧ�Ļ��Ϊ419kJmol-1����B����
C��ͼ�����߱仯�������仯��֪��b�����������������ߣ���ڢ��Ϊ���ȷ�Ӧ���ڢ���������������ڷ�Ӧ���ӦΪ���ȷ�Ӧ����C��ȷ��
D��b����ʹ�ô������˷�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ����ı䷴Ӧ����H����D����
E��b�����еڢ�εĻ��С�ڵڢ�εĻ�ܣ���Ӧ����������Ӧ���ʣ��ڢ�Σ��ڢ�Σ���E��ȷ��
�ʴ�Ϊ��ACE��
(3)�ٵõ��ӷ�����ԭ��Ӧ�ĵ缫Ϊ������ʧ���ӷ���������Ӧ�ĵ缫Ϊ����������aΪ������bΪ������b�缫�ϼ״�ʧ���ӷ���������Ӧ���ɶ�����̼��������ӦʽΪCH3OH -6e-+3 CO32��= 4 CO2��2H2O��
�ڸ���ͼ֪��aΪ������bΪ����������Ȼ�����Һʱ��mΪ������nΪ���������ݵ��ط�Ӧʽ2NaCl+2H2O![]() H2��+Cl2��+2NaOH���ڱ�״���£���ͨ��112mL��O2�����ʵ���Ϊ
H2��+Cl2��+2NaOH���ڱ�״���£���ͨ��112mL��O2�����ʵ���Ϊ![]() =0.005mol��ת�Ƶ���Ϊ0.005mol��4=0.02mol��������ÿת��2mol��������2molNaOH�����������NaOH0.02mol��Ũ��Ϊ
=0.005mol��ת�Ƶ���Ϊ0.005mol��4=0.02mol��������ÿת��2mol��������2molNaOH�����������NaOH0.02mol��Ũ��Ϊ![]() =0.1mol/L����ҺpH=13��
=0.1mol/L����ҺpH=13��
(4)��2nCO2��![]() ��̼�Ļ��ϼ۴�+4��Ϊ-2��ÿ��Cԭ�ӵõ�6�����ӣ���2nCO2�ܹ��õ�12n�����ӣ����ݵ���غ�ɵøõ缫��ӦʽΪ��2nCO2+12e-+12nH+=
��̼�Ļ��ϼ۴�+4��Ϊ-2��ÿ��Cԭ�ӵõ�6�����ӣ���2nCO2�ܹ��õ�12n�����ӣ����ݵ���غ�ɵøõ缫��ӦʽΪ��2nCO2+12e-+12nH+=![]() +4nH2O��
+4nH2O��
�ڹ�ҵ������1.4��102kg��LDPE������2nCO2��LDPE��֪����Ҫ������̼�����ʵ���Ϊ��![]() ��2n=1��104mol����������Ҫ��״����CO2������ǣ�22.4L/mol��1��104mol=2.24��105��
��2n=1��104mol����������Ҫ��״����CO2������ǣ�22.4L/mol��1��104mol=2.24��105��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ŧ�۵�����ִ��������й㷺Ӧ�á���һ����п�����ͼ��ʾ������ܷ�ӦΪ��
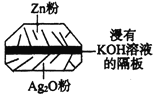
Zn + Ag2O + H2O = 2Ag + Zn(OH)2��������������ȷ���ǣ� ��
A.��ʹ�ù����У������KOH���ϱ�����
B.ʹ�ù����У�������Ag2O�������·����Zn��
C.������ӦʽΪ��Ag2O+H2O+2e- = 2Ag+2OH-
D.Zn�缫������ԭ��Ӧ��Ag2O�缫����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����A�ڿ����е�ȼ������ʻ�ɫ�������ɵ���ɫ����B����A�ڿ�����¶�ã�����ɰ�ɫ����C����A��BͶ��ˮ�ж�����D��B��C��D��һ�������¾����������̼��Ӧ��
��1��A��___��B��___��C��___��D��___�����ѧ���ţ�
��2��������з���ʽ��
B��H2O��Ӧ�Ļ�ѧ����___��
��C��ϡ��Һ��ͨ��CO2�����ӷ���ʽ____��
A��H2O��Ӧ�����ӷ���ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ(CuCl)�ǰ�ɫ��ĩ������ˮ�����������²��ȶ��������ɽ��� Cu ��Cu2+���㷺Ӧ���ڻ�����ӡȾ����ҵ��ij�о���ѧϰС�����ȷֽ� CuC122H2O �Ʊ� CuCl�����������̽��������˵������ȷ���ǣ� ��
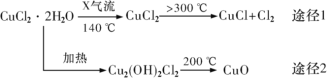
A.;�� 1 �в�����Cl2 ���Ի���ѭ������
B.;�� 2 �� 200��ʱ��Ӧ�Ļ�ѧ����ʽΪ��Cu2(OH)2Cl2![]() 2CuO+2HCl��
2CuO+2HCl��
C.X ������HCl��Ŀ�������� CuCl22H2O ���ȹ��̿��ܵ�ˮ��
D.CuCl ��ϡ���ᷴӦ�����ӷ���ʽΪ��2Cu++4H++SO42-�T2Cu2++SO2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�����ǽ�����������һ����������ӵ���������ϣ����������ߡ�ѭ���ȶ��Ժá��ɱ����е���Ҫ�ŵ㡣��������Ԫ������NiΪ��Ҫ����Ԫ�أ�ͨ�����Ա�ʾΪ��LiNiaCobMncO2������a+b+c=1���ɼ�дΪLiAO2�����ʱ�ܷ�ӦΪLiAO2 + nC = Li1-xAO2 + LixCn��0<x<1��������ԭ������ͼ��ʾ��������˵����ȷ���ǣ� ��

A. �ŵ�ʱNiԪ������ʧȥ����
B. �ŵ�ʱ���Ӵ�a�缫�ɵ�������b�缫
C. ���ʱ��������ӦʽΪLiAO2 - xe-= Li1-xAO2 + xLi+
D. ���ʱת��1mol���ӣ�����������������������7g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2017��3��21���ǵڶ�ʮ��조����ˮ�ա�������ˮ��Դ���������÷�ˮ��ʡˮ��Դ����ǿ��ˮ�Ļ��������ѱ�Խ��Խ���������ע����֪��ij��ɫ��ˮ�п��ܺ���H����NH4+��Fe3����Al3����Mg2����Na����NO3����CO32����SO42���еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100mL������������ʵ�飬��������й�ͼ��������ʾ��

��ش��������⣺
��1����������3��ʵ����Է�����ˮ��һ�������ڵ���������_________________��һ�����ڵ���������__________________________��
��2��д��ʵ���ͼ���г�����ʼ��������ȫ��ʧ�η�����Ӧ�����ӷ�Ӧ����ʽ��__________________��
��3������ͼ����ԭ��Һ��c(NH4+)��c(Al3��)�ı�ֵΪ______________________�����ó��������������_____________________g��
��4����ͨ��ʵ��ȷ��ԭ��ˮ��c(Na��)=0.14 mol��L1,���ж�ԭ��ˮ��NO3�Ƿ���ڣ�_______������ڡ��������ڡ���ȷ�������� �����ڣ�c(NO3)=___________mol��L1�����������ڻ�ȷ����˿ղ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������̼��![]() ���ǽ��Ǵ������һ����ɲ��֣����й���
���ǽ��Ǵ������һ����ɲ��֣����й���![]() ˵������ȷ���� ��������
˵������ȷ���� ��������
A. �ṹʽ����Ϊ��![]() B.
B. ![]() ��CO��
��CO��![]() ����̼��������
����̼��������
C. ![]() ����������������D.
����������������D. ![]() ��CO������ȼ������
��CO������ȼ������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��D��E��Ϊ��ѧ��ѧ�������ʻ������֮��Ĺ�ϵ��ͼ��ʾ�����ֲ�����ȥ��������˵��������ǣ�������
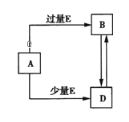
A. A��B��D�������Ƽ��仯���� B. A��B��D������þ���仯����
C. A��B��D�����������仯���� D. A��B��D�����Ƿǽ������仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״�����Ҫ�Ļ���ԭ�ϡ��ڴ����������£����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ϳɼ״�����Ҫ��ѧ��Ӧ���£�
��CO+2H2CH3OH
��CO2+3H2CH3OH+H2O
��CO2+H2CO+H2O
��ش��������⣺
��1����֪�������ʵı�ȼ�������±���
���� | CO(g) | H2(g) | CH3OH(l) |
ȼ����(kJ��mol1) | 283.0 | 285.8 | 726.51 |
����д25�桢101kPa����ʱCOȼ���ȵ��Ȼ�ѧ����ʽ______________________��
�ڼ���25�桢101kPa����ʱ��Ӧ�����H=_____kJ��mol1 ��
��2���״�ȼ�ϵ�أ�Direct Methanol Fuel Cell���������ӽ���Ĥȼ�ϵ�أ��乤��ԭ����ͼ��ʾ��
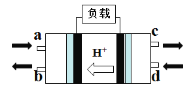
��c��������������________��
�ڸ����ĵ缫��Ӧʽ��____________��
��3����ͼ�Ǽ״�ȼ�ϵ�ع���ʾ��ͼ������A��B��D��Ϊʯī�缫��CΪͭ�缫������һ��ʱ��Ͽ�K����ʱA��B�����ϲ��������������ͬ��
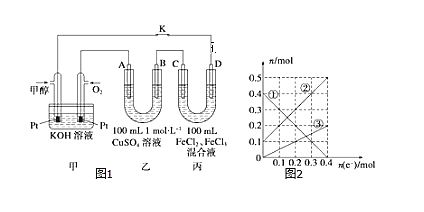
������B���ĵ缫��Ӧʽ_______��
������A�������������ڱ���µ����________��
�۱�װ����Һ�н��������ӵ����ʵ�����ת�Ƶ��ӵ����ʵ����仯��ϵ��ͼ������߱�ʾ����____�ı仯����Ӧ������Ҫʹ��װ���н���������ǡ����ȫ��������Ҫ____mL 5mol/LNaOH��Һ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com