
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;△\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3$\frac{\underline{\;△\;}}{\;}$Na2CO3+CO2↑+H2O | D. | CuO+CO═Cu+CO2 |
科目:高中化学 来源: 题型:解答题
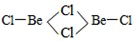 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
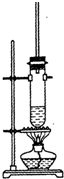 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图.下列对该实验的描述中错误的是( )| A. | 提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 | |
| B. | 长玻璃管起冷凝回流作用 | |
| C. | 不能用水浴加热 | |
| D. | 加入过量乙酸可以提高1一丁醇的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
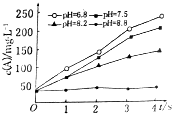 实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件不同).则下列有关说法正确的是( )| A. | 若增大压强,该反应的反应速率一定增大 | |
| B. | pH=6.8时,随着反应的进行反应速率逐渐增大 | |
| C. | 一定pH范围内,溶液中H+浓度越小反应速率越快 | |
| D. | 可采用调节pH的方法使反应停止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有Na2O2 | B. | 只有Na2O | C. | Na2O和Na2O2 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| B. | 已知酸性HF>CH3COOH,则pH相等的NaF与CH3COOK溶液中c(Na+)-c(F-)=c(K+)-c(CH3COO-) | |
| C. | 0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸pH=b,则a+1=b | |
| D. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c(NH4Cl)<c[(NH4)2CO3]<c[(NH4)2SO4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4gNH3中含N-H键数目为0.2NA | |
| B. | 乙烯和环丙烷(C2H4)组成的28g混合气体中含有2NA个氢原子 | |
| C. | 15.6gNa2O2跟过量CO2反应时,转移电子数为0.2NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-发生了氧化反应 | |
| B. | 氧化剂与还原剂的物质的量之比为1:3 | |
| C. | 方程式“□”中的应填入OH- | |
| D. | 氧化产物与还原产物物质的量之比是5:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com