
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取适量反应后的固体放入试管中, |

| SO2被氧化的程度 | V与m1或m2的关系 |
| 未被氧化 | |
| 完全被氧化 | V=0 |
| 部分被氧化 |
 ;
; ;
;| V |
| 22.4L/mol |
| 7m1 |
| 30 |
| 7m1 |
| 30 |
| 7m1 |
| 30 |


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖具有还原性 |
| B、葡萄糖的结构简式CH2OH(CHOH)4CHO |
| C、检测时NaAuCl4发生氧化反应 |
| D、纳米金单质颗粒分散在水中所得的分散系能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
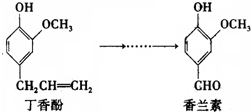
| A、香兰素分子中至少有12个原子共平面 |
| B、丁香酚不能与三氯化铁溶液发生显色反应 |
| C、1mol香兰素最多能与3mol氢气发生加成反应 |
| D、常温下1mol丁香酚只能与1molBr2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、①③ | C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、OH-、S2O32-、Cl- |
| B、Fe2+、K+、[Fe(CN)6]3-、NO3- |
| C、H+、C2O42-、MnO4-、SO42- |
| D、Na+、Ca2+、AlO2-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4和SiH4的熔点 |
| B、I2在H2O中的溶解能力和I2在CCl4中的溶解能力 |
| C、H2SO3和H2SO4的酸性 |
D、对羟基苯甲醛( )和邻羟基苯甲醛( )和邻羟基苯甲醛( )的沸点 )的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(SO42-)>n(NH4+)>n(Al3+)>n(OH-) |
| B、n(Al3+)>n(NH4+)>n(SO42-)>n(H+) |
| C、n(BaSO4)>n[Al(OH)3]>n(NH3?H2O)>n(AlO2-) |
| D、n(NH3?H2O)>n(BaSO4)>n[Al(OH)3]>n(AlO2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com