
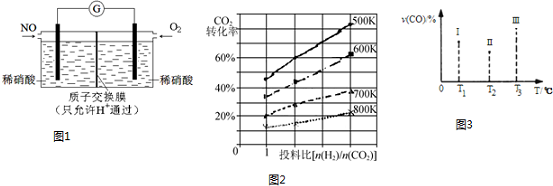
分析 (1)根据化合价的变化来确定电子转移数目;反应方程式中,化学计量数之比等于物质的量之比;
(2)根据盖斯定律进行计算,书写热化学方程式;
(3)在原电池的负极上发生失电子的氧化反应;
(4)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;根据温度对平衡的影响分析△H的符号;
(5)CO(g)+2H2(g)?CH3OH(g)△H<0,该反应正反应为放热反应,根据图3中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量,Ⅱ<Ⅰ<Ⅲ,结合化学平衡移动分析解答;
根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小.
解答 解:(1)NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5molO2(标准状况)时,转移电子的物质的量是1mol,当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的化学计量数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:1;6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)已知:①NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,
由②-①×2得:2NO(g)+O2(g)=2NO2(g),△H=-196.6kJ•mol-1-2×(-41.8kJ•mol-1)=-113.0 kJ•mol-1,
故答案为:2NO(g)+O2(g)=2NO2(g),△H=-113.0 kJ•mol-1;
(3)将NO转化为HNO3的原电池中,负极上发生一氧化氮失电子的氧化反应,即NO-3e-+2H2O=NO3-+4H+,
故答案为:NO-3e-+2H2O=NO3-+4H+;
(4)反应2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g),平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$,由图2可知:温度越高,CO2转化率越小,则平衡逆移,所以该反应正方向为放热反应,即△H<0,
故答案为:$\frac{c(C{H}_{3}OC{H}_{3})×{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})×{c}^{6}({H}_{2})}$;<;
(5)CO(g)+2H2(g)?CH3OH(g)△H<0,该反应正反应为放热反应,根据图3中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量由小到大依次为:Ⅱ<Ⅰ<Ⅲ,T1中的状态转变成T2中的状态,CO百分含量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,CO百分含量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是Ⅲ,该反应正反应为放热反应,升高温度,平衡逆向移动,若三个容器内的反应都达到化学平衡时,Ⅰ容器温度最低,所以CO转化率最大的反应温度是T1,
故答案为:Ⅲ;T1.
点评 本题考查的知识点较多,综合性较强,涉及氧化还原反应、化学方程式和电极反应式的书写、查盖斯定律的应用、平衡常数的计算、以及化学平衡的有关计算知识,难度较大.侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键.


科目:高中化学 来源: 题型:选择题
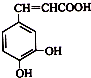
| A. | 该物质中苯环上一氯代物有2种 | |
| B. | 1 mol该物质可以与1.5 mol碳酸钠溶液反应生成1.5 mol CO2 | |
| C. | 既能发生取代反应,也能发生加成反应 | |
| D. | 所有碳原子不可能都在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 熔点由高到低:SiC>Si>SiO2>Ge | |
| C. | 沸点由高到低:NH3>PH3>AsH3>SbH3 | |
| D. | 晶格能由大到小:NaI>NaBr>NaCl>NaF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 通过灼热的铜网以除去H2中混有的O2 | |
| C. | Cu与浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 | |
| D. | pH小于7的雨水即为酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
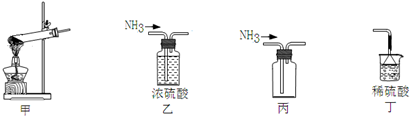
| A. | 用甲做发生装置 | B. | 用乙除去NH3中的杂质 | ||
| C. | 用丙来收集NH3 | D. | 用丁进行尾气处理并防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
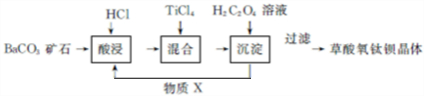
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②③④ | C. | ④⑤⑥ | D. | ②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 风能是人类通过风车等工具获取的能源,但属于一次能源 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 月球土壤中含有丰富的质量数为3的氦,它可作为未来核能的重要原料 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com