
| A. | BaCl2溶液 | B. | FeCl2溶液 | C. | FeCl3溶液 | D. | Fe(NO3)2溶液 |
分析 AgNO3、KSCN、NaCl、NaOH四种无色溶液分别与FeCl3溶液混合的现象为:白色沉淀、血红色溶液、无现象、红褐色沉淀,以此来解答.
解答 解:A.BaCl2溶液只能鉴别出AgNO3,故A不选;
B.FeCl2溶液不能鉴别KSCN、NaCl,故B不选;
C.AgNO3、KSCN、NaCl、NaOH四种无色溶液分别与FeCl3溶液混合的现象为:白色沉淀、血红色溶液、无现象、红褐色沉淀,现象不同,可鉴别,故C选;
D.Fe(NO3)2溶液不能鉴别KSCN、NaCl,故D不选;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握发生的反应及现象为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种一元弱酸HX、HY、HZ,其电离平衡常数依次减小,则同体积同pH的对应钠盐溶液中,水的电离度大小是NaX>NaY>NaZ | |
| B. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)=c( H+)+c(CH3COOH) | |
| C. | 0.1mol/LNaHS溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c( S2-)>c(HS-)>c(OH-) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)=c( SO42-)>c(NH4+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
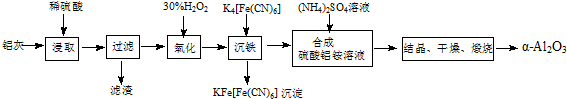
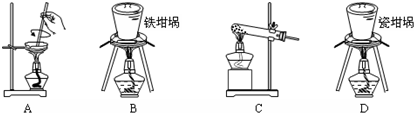
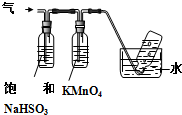
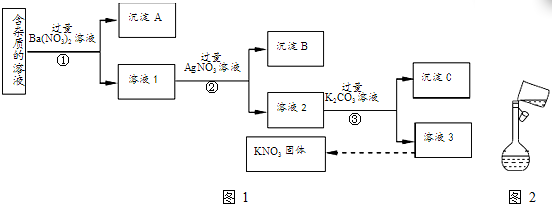
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑦⑧ | B. | ①④⑥⑦ | C. | ①②③⑤⑦ | D. | ④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):
A、B、C、D都是初中化学中的常见物质,具有如图所示的转化关系(反应条件、有些反应物或产 物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入反应物,使活化分子的百分数增加,反应速率加快 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小体积)可增加活化分子的百分数使化学反应速率增大 | |
| C. | 升高温度使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 活化分子间发生的碰撞为有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、SO42- | B. | K+、H+、HCO3- | C. | Cu2+、NO3-、SO42- | D. | Ba2+、NO3-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com