
| A、1mol苯分子中含有C=C双键数为3NA | ||
| B、1mol甲基(-CH3)所含的电子总数为10NA | ||
C、标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为
| ||
| D、4.2g乙烯和丙烯的混合气体中所含碳原子数为0.3NA |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
| 高温 |
| A、增加Fe的量 |
| B、将容器的容积缩小一半 |
| C、保持容积不变,充入H2O(g) |
| D、压强不变,充入N2使容器容积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、 ①②③④⑤ |
| C、①③④ | D、⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol西瓜 |
| B、摩尔是7个基本物理量之一 |
| C、常温常压下,22.4L氧气的物质的量为1mol |
| D、Na的摩尔质量为23g?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C、硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol丙烷完全燃烧需4mol氧气 |
| B、与丁烷互为同分异构体 |
| C、能使酸性高锰酸钾溶液褪色 |
| D、分子式为C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |



查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
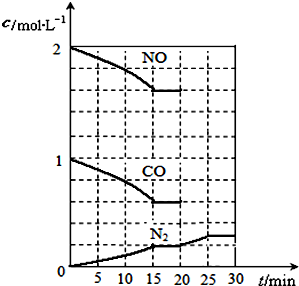 二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com