


科目:高中化学 来源: 题型:
| A、②③④⑤⑥ | B、②③④ |
| C、②⑤⑥ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
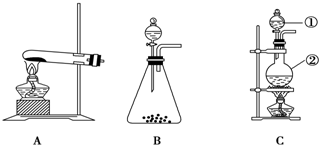
查看答案和解析>>
科目:高中化学 来源: 题型:
 Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似.白锡的密度大于灰锡的密度.
Sn是人类最早使用的元素之一,能形成SnCl2,SnCl4两种氯化物,SnCl2常温下为白色晶体,具有一维链状的聚合结构,气态时以单分子形式存在,而SnCl4常温下为无色液体.白锡和灰锡是Sn的两种同素异形体,白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似.白锡的密度大于灰锡的密度.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,烧杯中都盛有稀硫酸.
如图所示,烧杯中都盛有稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应 |
| B、等质量Na2CO3、NaHCO3分别与足量的同种盐酸反应,NaHCO3消耗盐酸比Na2CO3多 |
| C、等质量Na2CO3、NaHCO3分别与足量的稀H2SO4反应,NaHCO3产生CO2比Na2CO3多 |
| D、向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4═H2++SO42- |
| B、Ca(OH)2═Ca2++(OH)2- |
| C、AlCl3═Al+3+3Cl- |
| D、Al2(SO4)3═2Al3++3SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com