
铅蓄电池的工作原理为: Pb+PbO2+2H2SO4===2PbSO4+2H2O。研读下图,下列判断不正确的是( )
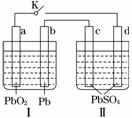
A. K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO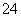
B. 当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C. K闭合时,Ⅱ中SO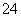 向c电极迁移
向c电极迁移
D. K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
利用右图装置探究铁在海水中的电化学防护。下列说法不正确是
A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B.若X为锌棒,开关K置于M处,铁极的反应:Fe-2e- = Fe2+
C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D.若X为碳棒,开关K置于N处,铁极的反应:2H+ + 2e – = H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
进行如下实验:在锥形瓶a中放入1 g绿豆粒大的碳酸钙,在锥形瓶b中加入1 g粉末状的碳酸钙,分别加入50 mL 1 mol·L-1的盐酸。如图所示(x表示时间,y表示生成气体的质量),能正确表示实验结果的是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的说法不正确的是 ( )
A.在测定中和反应的反应热实验中,要读取最高温度
B.中和滴定实验中,洗净后的锥形瓶不需要干燥
C.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
D.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)〈Ksp(CuS)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知苯酚能跟碳酸钠溶液反应生成苯酚钠。现有如下转化:




 COOH COONa COONa COONa
COOH COONa COONa COONa




 HO—
HO—




CH2OH CH2OH CH2OH CH2ONa
根据上述转化关系回答下列问题:
(1)a.羧基 b.酚羟基 c.醇羟基提供质子的能力是(填编号)_____________________。
(2)①~⑤编号所用的试剂分别是:①_____________;②_____________;
③_______________;④________________ ;⑤________________。
(3)写出苯酚与碳酸钠溶液反应的离子方程式
_________________________________________________。
(4)写出乙醇钠与水反应的化学方程式
________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
按如图所示装置进行实验,并回答下列问题:
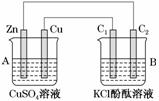 (1)判断装置的名称:A池为________,B池为________________。
(1)判断装置的名称:A池为________,B池为________________。
(2)锌极为________极,电极反应式为__________________;
铜极为________极,电极反应式为________________________________________
________________________________________________________________________;
石墨棒C1为____极,电极反应式为______________________________________
________________________________________________________________________;
石墨棒C2附近发生的实验现象为________________________________________
________________________________________________________________________。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量________(填“增加”或“减少”)________g,CuSO4溶液的质量________(填“增加”或“减少”)________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应aM(g)+bN(g)cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示。其中z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是( )
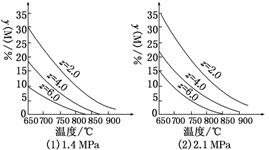
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B.同压同z时,升高温度,平衡时Q的体积分数增加
C.同温同z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加z,平衡时Q的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g)TaI4(g)+S2(g) ΔH>0 (Ⅰ)
反应(Ⅰ)的平衡常数表达式K=________,若K=1,向某恒容容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。
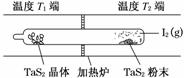
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(4)25 ℃时,H2SO3HSO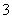 +H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中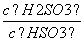 将________(填“增大”“减小”或“不变”)。
将________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于氧化还原反应的下列说法正确的是()
| A. | 含氧酸能起氧化作用,无氧酸则不能 | |
| B. | 阳离子只有氧化性,阴离子只有还原性 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 由X变为X2+的反应是氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com