£Ø2012?³¤ÄžĒųŅ»Ä££©¢ń£®¹¤ŅµÉĻµē½ā±„ŗĶŹ³ŃĪÄÜÖĘČ”¶ąÖֻƹ¤ŌĮĻ£¬ĘäÖŠ²æ·ÖŌĮĻæÉÓĆÓŚÖʱø¶ą¾§¹č£®
£Ø1£©ŌĮĻ“ÖŃĪÖŠ³£ŗ¬ÓŠÄąÉ³ŗĶCa
2+ӢMg
2+ӢFe
3+ӢSO
42-µČŌÓÖŹ£¬±ŲŠė¾«ÖĘŗó²ÅÄܹ©µē½āŹ¹ÓĆ£®¾«ÖĘŹ±£¬“ÖŃĪČÜÓŚĖ®¹żĀĖŗ󣬻¹ŅŖ¼ÓČėµÄŹŌ¼Į·Ö±šĪŖ¢ŁNa
2CO
3”¢¢ŚHCl£ØŃĪĖį£©¢ŪBaCl
2£¬Õā3ÖÖŹŌ¼ĮĢķ¼ÓµÄŗĻĄķĖ³ŠņŹĒ
¢Ū¢Ł¢Ś
¢Ū¢Ł¢Ś
£ØĢīŠņŗÅ£©Ļ“µÓ³żČ„NaCl¾§Ģå±ķĆęø½“ųµÄÉŁĮæKCl£¬Ń”ÓƵďŌ¼ĮĪŖ
¢Ū
¢Ū
£®£ØĢīŠņŗÅ£©£Ø¢Ł±„ŗĶNa
2CO
3ČÜŅŗ ¢Ś±„ŗĶK
2CO
3ČÜŅŗ ¢Ū75%ŅŅ“¼””¢ÜĖÄĀČ»ÆĢ¼£©
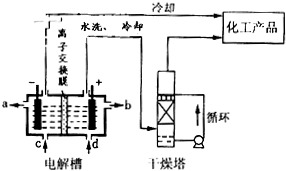
£Ø2£©ČēĶ¼ŹĒĄė×Ó½»»»Ä¤£ØŌŹŠķÄĘĄė×ÓĶعż£¬²»ŌŹŠķĒāŃõøłÓėĀČĄė×ÓĶعż£©·Øµē½ā±„ŗĶŹ³ŃĪĖ®Ź¾ŅāĶ¼£¬µē½ā²ŪŃō¼«²śÉśµÄĘųĢåŹĒ
ĀČĘų
ĀČĘų
£»NaOHČÜŅŗµÄ³öæŚĪŖ
a
a
£ØĢī×ÖÄø£©£»¾«Öʱ„ŗĶŹ³ŃĪĖ®µÄ½ųæŚĪŖ
d
d
£ØĢī×ÖÄø£©£»øÉŌļĖžÖŠÓ¦Ź¹ÓƵÄŅŗĢåŹĒ
ÅØĮņĖį
ÅØĮņĖį
£®
¢ņ£®¶ą¾§¹čÖ÷ŅŖ²ÉÓĆSiHCl
3»¹Ō¹¤ŅÕÉś²ś£¬Ęäø±²śĪļSiCl
4µÄ×ŪŗĻĄūÓƏܵ½¹ć·ŗ¹Ų×¢£®
£Ø1£©SiCl
4æÉÖĘĘųĻą°×ĢæŗŚ£ØÓė¹āµ¼ĻĖĪ¬Ö÷ŅŖŌĮĻĻąĶ¬£©£¬·½·ØĪŖøßĪĀĻĀSiCl
4ÓėH
2ŗĶO
2·“Ó¦£¬²śĪļÓŠĮ½ÖÖ£¬»Æѧ·½³ĢŹ½ĪŖ
£®
£Ø2£©SiCl
4æÉ×Ŗ»ÆĪŖSiHCl
3¶ųŃ»·Ź¹ÓĆ£®Ņ»¶ØĢõ¼žĻĀ£¬ŌŚ20LŗćČŻĆܱÕČŻĘ÷ÖŠµÄ·“Ó¦£ŗ
3SiCl
4£Øg£©+2H
2£Øg£©+Si£Øs£©?4SiHCl
3£Øg£©
“ļĘ½ŗāŗó£¬H
2ÓėSiHCl
3ĪļÖŹµÄĮæÅØ¶Č·Ö±šĪŖ0.140mol/LŗĶ0.020mol/L£¬ČōH
2Č«²æĄ“Ō“ÓŚĄė×Ó½»»»Ä¤·ØµÄµē½ā²śĪļ£¬ĄķĀŪÉĻŠčĻūŗÄ“æNaClµÄÖŹĮæĪŖ
0.351
0.351
kg£®
£Ø3£©ŹµŃéŹŅÖʱøH
2ŗĶCl
2Ķس£²ÉÓĆĻĀĮŠ·“Ó¦£ŗ
Zn+H
2SO
4”śZnSO
4+H
2”ü£»MnO
2+4HCl£ØÅØ£©
MnCl
2+Cl
2ӟ+2H
2O
¾Ż“Ė£¬“ÓĻĀĮŠĖłøųŅĒĘ÷×°ÖĆÖŠŃ”ŌńÖʱø²¢ŹÕ¼ÆH
2µÄ×°ÖĆ
e
e
£ØĢī“śŗÅ£©ŗĶÖʱø²¢ŹÕ¼ÆøÉŌļ”¢“æ¾»Cl
2µÄ×°ÖĆ
d
d
£ØĢī“śŗÅ£©£®
æÉŃ”ÓĆÖʱøĘųĢåµÄ×°ÖĆ£ŗ
£Ø4£©²ÉÓĆĪŽÄ¤µē½ā²Ūµē½ā±„ŗĶŹ³ŃĪĖ®£¬æÉÖĘČ”ĀČĖįÄĘ£¬Ķ¬Ź±Éś³ÉĒāĘų£¬ĻÖÖʵĆĀČĖįÄĘ213.0kg£¬ŌņÉś³ÉĒāĘų
134.4
134.4
m
3£Ø±ź×¼×“æö£©£®£ØŗöĀŌæÉÄÜ“ęŌŚµÄĘäĖū·“Ó¦£©
ij¹¤³§Éś²śÅšÉ°¹ż³ĢÖŠ²śÉśµÄ¹ĢĢå·ĻĮĻ£¬Ö÷ŅŖŗ¬ÓŠMgCO
3ӢMgSiO
3”¢CaMg£ØCO
3£©
2ӢAl
2O
3ŗĶFe
2O
3µČ£¬»ŲŹÕĘäÖŠĆ¾µÄ¹¤ŅÕĮ÷³ĢČēĻĀ£ŗ
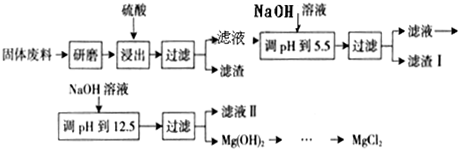
| ³ĮµķĪļ |
Fe£ØOH£©3 |
Al£ØOH£©3 |
Mg£ØOH£©2 |
| PH |
3.2 |
5.2 |
12.4 |
¢ó£®²æ·ÖŃōĄė×ÓŅŌĒāŃõ»ÆĪļŠĪŹ½ĶźČ«³ĮµķŹ±ČÜŅŗµÄpH¼ūÉĻ±ķ£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©”°½ž³ö”±²½ÖčÖŠ£¬ĪŖĢįøßĆ¾µÄ½ž³öĀŹ£¬æɲÉČ”µÄ“ėŹ©ÓŠ
ŹŹµ±Ģįøß·“Ó¦ĪĀ¶Č”¢Ōö¼Ó½ž³öŹ±¼ä
ŹŹµ±Ģįøß·“Ó¦ĪĀ¶Č”¢Ōö¼Ó½ž³öŹ±¼ä
£ØŅŖĒ󊓳öĮ½Ģõ£©£®
£Ø2£©ĀĖŌüIµÄÖ÷ŅŖ³É·ÖŹĒ
Fe£ØOH£©3”¢Al£ØOH£©3
Fe£ØOH£©3”¢Al£ØOH£©3
£®
Mg£ØClO
3£©
2ŌŚÅ©ŅµÉĻæÉÓĆ×÷ĶŃŅ¶¼Į”¢“ߏģ¼Į£¬æɲÉÓĆø“·Ö½ā·“Ó¦Öʱø£ŗ
MgCl
2+2NaClO
3”śMg£ØClO
3£©
2+2NaCl
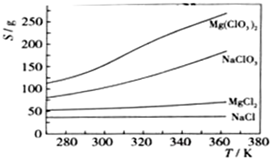
ŅŃÖŖĖÄÖÖ»ÆŗĻĪļµÄČܽā¶Č£ØS£©ĖęĪĀ¶Č£ØT£©±ä»ÆĒśĻßČēĶ¼ĖłŹ¾£ŗ
£Ø3£©½«·“Ó¦Īļ°“»Æѧ·“Ó¦·½³ĢŹ½¼ĘĮæŹż±Č»ģŗĻÖʱøMg£ØClO
3£©
2£®¼ņŹöæÉÖʱøMg£ØClO
3£©
2µÄŌŅņ£ŗ
ŌŚÄ³Ņ»ĪĀ¶ČŹ±£¬NaCl×īĻČ“ļµ½±„ŗĶĪö³ö£»Mg£ØClO3£©2µÄČܽā¶ČĖęĪĀ¶Č±ä»ÆµÄ×ī“ó£¬NaClµÄČܽā¶ČÓėĘäĖūĪļÖŹµÄČܽā¶ČÓŠŅ»¶ØµÄ²ī±š£»
ŌŚÄ³Ņ»ĪĀ¶ČŹ±£¬NaCl×īĻČ“ļµ½±„ŗĶĪö³ö£»Mg£ØClO3£©2µÄČܽā¶ČĖęĪĀ¶Č±ä»ÆµÄ×ī“ó£¬NaClµÄČܽā¶ČÓėĘäĖūĪļÖŹµÄČܽā¶ČÓŠŅ»¶ØµÄ²ī±š£»
£®
£Ø4£©°“Ģā£Ø3£©ÖŠĢõ¼ž½ųŠŠÖʱøŹµŃ飮ŌŚĄäČ“½µĪĀĪö³öMg£ØClO
3£©
2¹ż³ĢÖŠ£¬³£°éÓŠNaClĪö³ö£¬ŌŅņŹĒ£ŗ
½µĪĀĒ°£¬ČÜŅŗÖŠNaClŅŃ“ļ±„ŗĶ£¬½µµĶ¹ż³ĢÖŠ£¬NaClČܽā¶Č»į½µµĶ£¬»įÉŁĮæĪö³ö£»
½µĪĀĒ°£¬ČÜŅŗÖŠNaClŅŃ“ļ±„ŗĶ£¬½µµĶ¹ż³ĢÖŠ£¬NaClČܽā¶Č»į½µµĶ£¬»įÉŁĮæĪö³ö£»
£®³żČ„²śĘ·ÖŠøĆŌÓÖŹµÄ·½·ØŹĒ£ŗ
ÖŲ½į¾§
ÖŲ½į¾§
£®










