
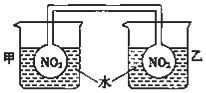
 利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程.分析 (1)CaO与水反应生成氢氧化钙,该反应是放热反应,结合反应物、生成物总能量与反应热的关系分析;
(2)2NO2(g)?N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都加快,混合气体的颜色不变说明二氧化氮的浓度不变,化学反应达平衡状态.
解答 解:(1)CaO与水反应生成氢氧化钙,反应方程式为CaO+H2O═Ca(OH)2,该反应为放热反应,则反应物的总能量大于生成物的总能量,
故答案为:CaO+H2O═Ca(OH)2;大于;
(2)2NO2(g)?N2O4(g)正反应是放热反应,所以升高温度逆向移动,正逆反应速率都增大,混合气体的颜色不变说明二氧化氮的浓度不变,说明正逆反应速率相等,该化学反应达平衡状态,
故答案为:发生移动;增大;能.
点评 本题考查化学平衡的影响因素、反应热与焓变,题目难度不大,明确化学平衡及其影响为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及综合应用能力.


科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验步骤和装置 | |
| A | 探究温度对反应速率的影响 | 不同温度下,分别取同体积0.1mol•L-1KI溶液,向其中匀先加入淀粉溶液3滴,再各加入0.1mol•L-1硫酸5滴,并同时记录溶液出现蓝色的时间 |
| B | 配制100mL1.0mol•L-1NaOH溶液 | 向100mL容量瓶中加入4.0gNaOH固体,加水到刻度线 |
| C | 验证牺牲阳极的阴极保护法 | 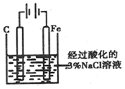 往铁电极附近滴加铁氯化钾溶液 |
| D | 比较H2O2和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:4 | C. | 2:3 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
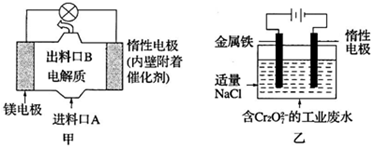
| A. | 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中惰性电极棒上有O2放出 | |
| C. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| D. | 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 400℃时,生成的产物有N2、NO、H2O | |
| B. | 800℃时,反应的化学方程式是:4NH3+5O2$\frac{\underline{\;Pt-Rh\;}}{800℃}$ 4NO+6H2O | |
| C. | 400℃-800℃间,Pt-Rh合金对N2的吸附力逐渐减弱 | |
| D. | 800℃以上,发生了反应:2NO(g)?O2(g)+N2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气取代反应的产物二氯代甲烷无同分异构体说明甲烷是正四面体结构 | |
| B. | 等物质的量的乙烷与乙酸完全燃烧消耗氧气的量相等 | |
| C. | 按系统命名法,化合物 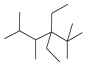 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| D. | 结构简式为 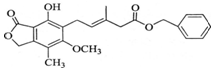 的化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 的化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com