
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 | |
| C. | 若反应在密闭体系内进行,通入He气,体系压强增大,反应速率增大 | |
| D. | 若反应在恒压体系内进行,通往He气,体系压强不变,反应速率不变 |
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
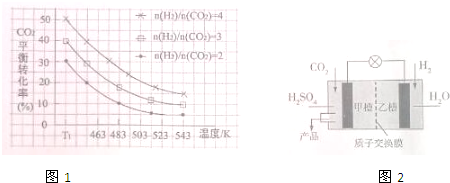
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
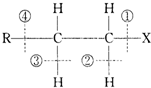
| A. | 该卤代烃发生水解反应时,被破坏的键是①和④ | |
| B. | 该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键是① | |
| D. | 当该卤代烃发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | R | |
| Y | Z |
| A. | 粒子半径:原子半径最大的是W,简单阴离子半径最小的是R | |
| B. | 单质:氧化性最强的是Z,还原性最强的是Y | |
| C. | 最高价氧化物对应水化物:酸性最强的是Z,水溶性最差的是Y | |
| D. | 最简单氢化物:沸点最高的是X,稳定性最差的是W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
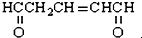 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A. | 1 mol 2 mol | B. | 1 mol 4 mol | C. | 3 mol 2 mol | D. | 3 mol 4 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.1mol桶烯完全燃烧需要消耗氧气22.4L | |
| B. | 桶烯在一定条件下能发生加成反应,不能发生加聚反应 | |
| C. | 桶烯二氯取代产物只有三种 | |
| D. | 桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
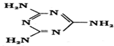 ,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
,则其中氮原子轨道杂化类型是sp2、sp3,l mol三聚氰胺分子中含15molσ键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解、电镀、电化学腐蚀都需要通电才可进行 | |
| B. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| C. | 浓H2SO4和新制氯水分别滴在pH试纸上均会出现先变红后褪色的现象 | |
| D. | 氢氧化铝可以中和过多的胃酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com