
【题目】【2017上海模拟】升高温度,下列数据不一定增大的是( )
A.化学反应速率v B.弱电解质的电离度α
C.化学平衡常数K D.水的离子积常数Kw
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种钠的化合物,其中A为淡黄色粉末,B、C、D为白色固体,它们相互之间有下列关系。

试回答下列问题:
⑴试写出A、B、C、D的化学式:A:_______、D:_______、E:________。
⑵写出反应②的离子方程式:__________________。
⑶写出B与C溶液反应的离子方程式:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内为加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
2NH3(g) ΔH<0反应中NH3的物质的量浓度的变化的情况如图所示:
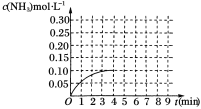
(1)根据上图,计算从反应开始到平衡时,平均反应速率υ(NH3)=___________ mol·L-1·min-1。
(2)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,则NH3的物质的量浓度不可能为____________(填字母序号)。
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(3)该反应平衡常数K=____________。
(4)反应达到平衡后,第5分钟末,保持其他条件不变,若只把容器的体积缩小一半,平衡________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数____________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(设此时NH3的浓度为0.25 mol·L-1)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关烷烃性质的叙述不正确的是( )
A. 常温下烷烃与酸、碱、强氧化剂不反应
B. 烷烃都具有还原性,能被氧气氧化
C. 烷烃都能燃烧生成二氧化碳和水
D. 烷烃能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种典型的非金属元素,请回答下列问题:
(1)硫元素的非金属性___________氯元素(填“大于”或“小于”),请用一个事实来说明_______________________。
(2)氧硫化碳(COS)可作储粮杀虫剂,已知COS与CO2的结构相似,试写出COS的电子式______,COS属于_______分子(填“极性”或“非极性”)。COS的沸点___________CO2的沸点(填“大于”或“小于”),并说出理由_______________________。
(3)冷的浓硫酸可以用铁制容器储存,是因为铁在冷的浓硫酸中发生了_______________现象。但是在加热条件下,浓硫酸还是可以和铁反应的。
①写出铁在加热条件下和足量浓硫酸反应的化学方程式,并标出电子转移方向与数目_____________________。
②上述反应中________元素被还原,还原产物是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,达到平衡后,以下分析正确的是( )
2NH3(g) ΔH<0,达到平衡后,以下分析正确的是( )
A.增大压强,对正反应的反应速率影响更大
B.升高温度,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的用途的说法不正确的是
A. 磁性氧化铁可用于制备红色颜料和油漆
B. 氢氧化铝、碳酸氢钠可用于治疗胃酸过多
C. 钢罐可用于储运浓硫酸
D. SO2可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列各烷烃的分子式。
①烷烃A在同温同压下,蒸气密度是H2的43倍,则A为 。
②1 L烷烃C的蒸气完全燃烧时,生成同温同压下15 L的水蒸气,则C为___________。
③烷烃D分子中含有22条共价键,则D为_____________。
(2)相对分子质量为72的烷烃,若此有机物的一氯代物分子中有两个—CH3,两个—CH2—,一个![]() 和一个—Cl,它的可能结构有种 。
和一个—Cl,它的可能结构有种 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是生命的基础,由于存在着氮的循环,生命世界才能像我们所见到的那样生机勃勃,充满活力.如图是自然界中氮的循环图,请分析此图并回答有关问题.
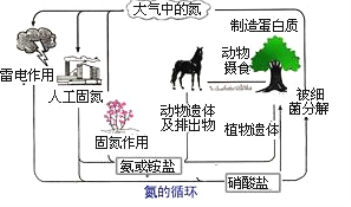
(1)大气中的氮以_____(填化学式)形式存在。图中共表示了_______种固氮的途径。
(2)由图可知,动植物体内的氮主要存在于蛋白质中,当动植物尸体发生腐败时,往往会产生一种含氮的气体,其电子式为___________。土壤中的硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:K2S+KNO3+H2O![]() N2+K2SO4+KOH
N2+K2SO4+KOH
(3)上述反应中涉及1~18号元素的原子半径从大到小的顺序是_________________。属于共价化合物的反应物(或生成物)的结构式是_____________。
(4)配平上述反应方程式,并标出电子转移的方向和数目_____________。上述反应的氧化剂是_________________,被氧化的元素是____________________。
(5)上述过程的发生改变了土壤的成分,从而对农业生产产生一定的不利影响,请选择任一角度进行简要说明:_______________________。
(6)工业合成氨的简易流程如下图,通过循环Ⅰ可利用的气态物质是_____________

a.催化剂 b.只有N2 c.只有H2 d.N2和H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com