
【题目】设阿伏加德罗常数为NA , 则下列说法正确的是( )
A.15g甲基(﹣CH3)所含有的电子数是9NA
B.7.8g ![]() 中含有的碳碳双键数为0.3NA
中含有的碳碳双键数为0.3NA
C.1mol C2H5OH和1mol CH3CO18OH反应生成水的中子数为8NA
D.标准状况下,11.2L己烷所含分子数为0.5NA
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】铝是一种很重要的金属,可以发生一系列反应制备物质. 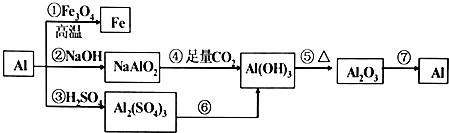
回答下列问题:
(1)反应①可以用于(说出一条).
(2)②③反应产生等量氢气消耗的NaOH与H2SO4的物质的量之比为 .
(3)反应④的离子反应的方程式为 .
(4)用反应⑥制备Al(OH)3 , 最好是向A12(SO4)3溶液中滴加 , 离子方程式为 .
(5)工业上常用反应⑦制备金属铝,制备过程的方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100mL稀硝酸中完全溶解,反应过程中无气体放出。向反应后的溶液中,逐滴加入1.00 mol/L NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示,则下列说法错误的是

A. 合金中镁铝的物质的量之比为1:2
B. 合金完全溶解转移电子的物质的量为0. 032mol
C. 原稀硝酸的物质的量浓度为0. 45 mol/L
D. F点溶液中,溶质仅为Na[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锆是重要的耐高温材料、陶瓷绝缘材料.以锆英砂(主要成分为ZrSiO4 , 还含有少量Fe2O3、Al2O3、SiO2等杂货)为原料制备二氧化锆(ZrO2)的工艺流程如图所示.  已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO2 , Na2ZrO2与酸反应生成ZrO2+
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表
离子 | Fe3+ | AP+ | ZrO2+ |
开始沉淀pH | 1.9 | 3.3 | 6.2 |
完仝沉淀pH | 3.2 | 5.2 | 8.0 |
(1)经熔融后,锆英砂中Zr元素以(写化学式)形式存在,写出酸浸时生成Al3+、Fe3+的离子方程式:
(2)滤渣I的主要成分的名称为
(3)向过滤Ⅰ所得溶液中加氨水调pH=a,其目的是然后继续加氨水至pH=b的范围是
(4)向过滤Ⅲ所得溶液中加入CaCO2粉末并加热,可得CO2和另一种气体,该反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)作为一种重要的无机化工原料,在涂料、有色玻璃和催化剂等领域有着广泛的用途.回答下列问题:
(1)添加Cu2O的涂料或玻璃显色.
(2)制备氧化亚铜的方法之一是用铜作阳极电解NaCl和NaOH混合溶液,其原理如图所示: 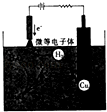
①阴极的电极反应式为 .
②溶液中CuCln1﹣n转化为Cu2O的离子方程式为
(3)工业生产中常采用高温煅烧氧化铜粉末制备Cu2O,但所得产品中会含有一定量CuO,测定产品中Cu2O的含量常用滴定法,其原理为: 样品溶解:Cu2O+Fe2(SO4)3+H2SO4═2FeSO4+2CuSO4+H2O.
滴定(未配平):□FeSO4+□KMnO4+□H2SO4═□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
①配平滴定反应的化学方程式.
②滴定时,KMnO4溶液盛放在(填“酸式”或“碱式”)滴定管中.
③若产品质量为1.0g,滴定时消耗0.10molL﹣1的KMnO4标准溶液20.00mL,则产品中Cu2O的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

(1)表中硫酸的质量分数W1为_____(不写单位,用含c1、p1的代数式表示)。
(2)物质的量浓度为c1mol· L-1质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________ mol· L-1,质量分数_______w1/2(填“大于”、“小于”或“等于”,下同)。
(3)质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下一定能大量共存的是( )
A.在碱性溶液中:CO32﹣、K+、S2﹣、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3﹣、Mg2+、Na+、SO42﹣
C.在 ![]() ?=1×1012的溶液中:NH4+、AlO2﹣、C1﹣、K+
?=1×1012的溶液中:NH4+、AlO2﹣、C1﹣、K+
D.在中性溶液中:Fe3+、C1﹣、NO3﹣、A13+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验,能成功的是( )
A.苯和溴水、铁屑混合制溴苯
B.用溴水除乙烷中混有的乙烯
C.苯与浓硝酸和浓硫酸的混合物共热至70℃~80℃制硝基苯
D.用酒精和浓盐酸通过加热来制取乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用固体烧碱配制500mL 0.10 mol·L-1的NaOH 溶液,需要称取______g固体,称量NaOH固体时需要的仪器有_____________________,定容时所需的仪器有________________。
(2)实验室要用98%(ρ=1.84g·cm-3)的硫酸配制0.5mol·L-1的硫酸溶液250mL,需准确量取98%的硫酸_______mL,需要选择_______ml量筒。
(3)若配制0.5mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,下列所配制的硫酸溶液浓度偏低的是_________________________。
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.移液时容量瓶中有少量蒸馏水
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com