
下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是( )
| A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 |
| B.同价态的阳离子,甲比乙的氧化性强 |
| C.甲能跟稀盐酸反应放出氢气而乙不能 |
| D.将甲、乙作电极组成原电池时,甲是正极 |
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:单选题
已知H2O2是一种弱酸,在强碱溶液中主要以HO2-形式存在。以Al—H2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气 (电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法不正确的是 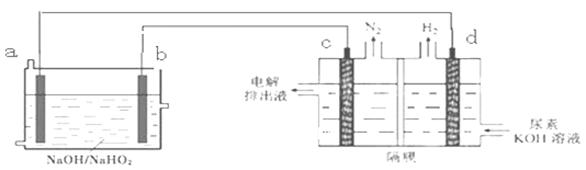
| A.燃料电池的总反应为:2Al+3HO2-= 2AlO2- + OH- +H2O |
| B.电极b是正极,且反应后该电极区pH增大 |
| C.电解过程中,电子的流向由a→b→c→d. |
| D.电解时,Al消耗2.7g,则产生氮气标准状况下为1.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
| D.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。则下列说法正确的是( )
| A.电池工作时,MnO2发生还原反应 |
| B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- |
| C.电池工作时,K+移向负极 |
| D.电池工作时,电路中每通过0.1mol电子,锌的质量理论上减少6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是 ( )
| A.放电时,LiMn2O4发生氧化反应 |
| B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4 |
| C.充电时,LiMn2O4发生氧化反应 |
| D.充电时,阳极反应为:Li++e-==Li |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知空气-锌电池的电极反应:
锌片:Zn-2OH--2e- = ZnO + H2O,石墨:1/2 O2+H2O +2e- = 2OH-
据次推断锌片是
| A.负极,被氧化 | B.负极,被还原 | C.正极,被氧化 | D.正极,被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
英国赫瑞瓦特大学陶善文博士研究出以尿素为动力的燃 料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,关于该电池描述正确的是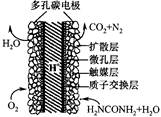
| A.电池工作时H+移向负极 |
| B.该装置还可以将电能转化成为化学能 |
| C.理论上电池工作时,每消耗67.2L O2时,可以净化2mol CO(NH2)2 |
| D.电池的负极反应式为:CO(NH2)2+H2O-6e-=CO2+N2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在理论上可用于设计原电池的化学反应是
| A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0 |
| B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0 |
| C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0 |
D.FeCl3(aq)十3H2O(1)  Fe(OH)3(s)+3HCl(aq);△H >0 Fe(OH)3(s)+3HCl(aq);△H >0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某电化学实验装置如图所示,下列说法正确的是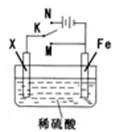
| A.若X为碳棒,开关K置于M处,则溶液中的H+移向Fe极 |
| B.若X为碳棒,开关K置于N处,转移0.2mole一时析出0.lmolO2 |
| C.若X为铜棒,开关K置于M或N处,均可减缓铁的腐蚀 |
| D.若X为锌棒,开关K置于M或N处,锌电极上反应均为Zn-2e一=Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com