
【题目】草酸铝是一种不溶于水和醇,溶于强酸的白色粉末,是重要的媒染剂。某化学兴趣小组设计实验从废弃铝—空气海水电池中回收铝并制备草酸铝晶体。
【实验过程】
(一)铝的回收
①称取16.0g废弃电池原料;
②用98.3%的硫酸进行酸浸、稀释、除杂、过滤;
③将滤液蒸干得到硫酸铝固体mlg.
(二)草酸铝的制备
④配制250mL0.20mol/L的硫酸铝溶液;
⑤量取0.10mol/L的草酸铵溶液20.00mL,并加入一定量的分散剂,缓缓加入配制的硫酸铝溶液25.00mL,搅拌lh;
⑥沉化、抽滤、洗涤、干燥、称量固体质量为m2g。
【问题讨论】
(1)在用98.3%的硫酸进行酸浸时,浸出率与条件的关系如图所示:

由图可知浓硫酸为浸取剂的最佳条件为________。
(2)步骤③蒸干溶液所需的仪器有带铁圈的铁架台、酒精灯、_______、_______。
(3)铝的回收率为_______ (回收率=回收铝的质量/原料的质量)。
(4)步骤⑥中洗涤晶体时先用蒸馏水再用乙醇洗涤,这样洗涤的原因是_______。
(5)该研究小组在实验过程中发现,若用0.90mol/L草酸铵进行实验,会导致沉淀的质量远超过实际草酸铝的质量。经分析,结晶生成物为(NH4)xAly(C2O4)z·nH2O。 现称取3.990g该结晶水合物进行热分解,得到剩余固体的质量随温度变化的曲线如下图所示。己知450℃时剩余固体只有Al2O3。第II阶段共产生气体2.016L (标准状况),该气体通入足量的石灰水中产生3.000g沉淀。请计算求出该结晶水合物的化学式为______。

【答案】 100℃ 浓硫酸质量40g[或m(浓硫酸):m(海水电池产物)=5: 2] 蒸发皿,玻璃棒 ![]() 先用水冼去晶体表面附着的杂质离子,再用乙醇洗涤可快速干燥 (NH4)3Al(C2O4)3·3H2O
先用水冼去晶体表面附着的杂质离子,再用乙醇洗涤可快速干燥 (NH4)3Al(C2O4)3·3H2O
【解析】 (1)在用98.3%的硫酸进行酸浸时,根据浸出率与条件的关系图可知,在100℃时,浸出率已经很高,再升高温度,浸出率基本不变,升高温度,对设备的要求增大,消耗的能量更多,浸取剂的最佳温度为100℃,根据右图可知,浓硫酸质量40g时,浸出率已经很高,再增大浓硫酸质量,浸出率基本不变,浸取剂的最佳用量为浓硫酸质量40g,此时m(浓硫酸):m(海水电池产物)=40g:16g=5: 2,故答案为:100℃,浓硫酸质量40g[或m(浓硫酸):m(海水电池产物)=5: 2];
(2)步骤③蒸干溶液所需的仪器有带铁圈的铁架台、酒精灯、蒸发皿、玻璃棒,故答案为:蒸发皿、玻璃棒;
(3) mlg硫酸铝中含有铝元素的质量为mlg×![]() ,则铝的回收率=
,则铝的回收率=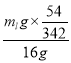 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%;
×100%;
(4)步骤⑥中洗涤晶体时先用蒸馏水再用乙醇洗涤,先用水冼可以洗去晶体表面附着的杂质离子,再用乙醇洗涤可快速干燥,故答案为:先用水冼去晶体表面附着的杂质离子,再用乙醇洗涤可快速干燥;
(5)第I阶段是脱去结晶水,结晶水的质量为3.990g-3.450g=0.540g,物质的量为![]() =0.03mol;n(Al2O3)=
=0.03mol;n(Al2O3)= ![]() =0.005mol,含有铝元素的物质的量为0.005mol×2=0.01mol;生成碳酸钙的质量为3.000g,物质的量=
=0.005mol,含有铝元素的物质的量为0.005mol×2=0.01mol;生成碳酸钙的质量为3.000g,物质的量=![]() =0.03mol,故生成的气体中含有0.03molCO2,二氧化碳的质量为0.03mol×44g/mol=1.32g;因为气体的物质的量为
=0.03mol,故生成的气体中含有0.03molCO2,二氧化碳的质量为0.03mol×44g/mol=1.32g;因为气体的物质的量为![]() =0.09mol,则生成的CO和氨气共有0.06mol,即n(CO)+n(NH3)=0.06mol;根据氢原子守恒,第二阶段生成水的物质的量是氨气的一半,根据质量守恒,CO和氨气的质量之和为3.990g-1.32g-0.510g-0.540g=1.62g,则n(CO)×28g/mol+n(NH3)×17g/mol+ n(NH3)×
=0.09mol,则生成的CO和氨气共有0.06mol,即n(CO)+n(NH3)=0.06mol;根据氢原子守恒,第二阶段生成水的物质的量是氨气的一半,根据质量守恒,CO和氨气的质量之和为3.990g-1.32g-0.510g-0.540g=1.62g,则n(CO)×28g/mol+n(NH3)×17g/mol+ n(NH3)×![]() ×18g/mol =1.62g,解得n(CO)=0.03mol,n(NH3)=0.03mol,根据碳原子守恒,含有草酸根离子的物质的量为
×18g/mol =1.62g,解得n(CO)=0.03mol,n(NH3)=0.03mol,根据碳原子守恒,含有草酸根离子的物质的量为![]() =0.03mol,因此n(NH4+):n(Al3+): n(C2O42-):n(H2O)=3:1:3:3,该结晶水合物的化学式为(NH4)3Al(C2O4)3·3H2O,故答案为:(NH4)3Al(C2O4)3·3H2O。
=0.03mol,因此n(NH4+):n(Al3+): n(C2O42-):n(H2O)=3:1:3:3,该结晶水合物的化学式为(NH4)3Al(C2O4)3·3H2O,故答案为:(NH4)3Al(C2O4)3·3H2O。


科目:高中化学 来源: 题型:
【题目】物质A~I之间能发生如下反应(图中部分反应的条件和产物没有全部标出),其中A,B,C,I为金属单质,B是地壳中含量最多的金属,甲、乙、丙为气体. 
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:C、H .
(2)写出气体甲在气体乙中燃烧的化学方程式:;该反应的现象有: .
(3)写出反应③的化学方程式:;向反应③所得溶液中通入过量的CO2 , 写出反应的离子方程式: .
(4)写出反应⑤的离子方程式:;
(5)检验物质D中阳离子的方法名称是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 ①CH2OH(CHOH)4CHO、②CH3CH2CH2OH、③CH2=CH—CH2OH、
④CH2=CH—COOCH3、⑤CH2=CH—COOH中,既能发生加成反应和酯化反应,又能发生氧化反应的是( )
A. ③⑤ B. ①③⑤ C. ②④ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.1mol/L的NaClO溶液中含有C1O-的数目小于NA
B. 标准状况下,将22.4LC12通入水中,发生反应后,转移的电子数为NA
C. 100g46%的乙醇溶液中,含H-O键的数目为NA
D. 4.6gNa在空气中完全反应生成Na2O、Na2O2,转移0.2NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C6H12O2的酯水解后得到醇A和B,若A经氧化能生成B,则C6H12O2应是下列的( )
A.HCOO(CH2)4CH3B.CH3COO(CH2)3CH3
C.C2H5COO(CH2)2CH3D.CH3(CH2)2COOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在同温同压下,甲容器中的氧气(O2)和乙容器中的氨气(NH3)所含的原子个数相同,则甲、乙两容器中气体的体积之比为1:2
B.任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等
C.在标准状况时,20mL NH3与60mL N2所含的原子个数比为1:3
D.同温同压下,1L一氧化碳气体一定比1L氧气的质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质(或主要成分)对应的化学式中,不正确的是
A.小苏打 NaHCO3B.钡餐 BaCO3
C.绿矾 FeSO4·7H2OD.胃舒平 Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com