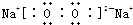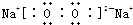解:A元素原子核内只有一个质子判断为H,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L
-1,计算得到气体摩尔质量=22.4L/mol×0.759g?L
-1=17g/mol;推断为NH
3,B为N,C元素原子的最外层电子数是其电子层数的3倍判断C为O,E与C同主族判断E为S;元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素判断为Al、Fe;
(1)化合物甲为NH
3,它的电子式为:
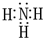
,故答案为:
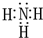
;
(2)化合物甲的水溶液为氨水溶液,与D元素对应的金属阳离子为Al
3+,反应的离子方程式为:3NH
3?H
2O+Al
3+=Al(OH)
3↓+3NH
4+;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应,均含有Fe元素的乙与丁在溶液中发生反应的离子方程式是铁和铁离子发生的氧化还原反应,反应的离子方程式为:Fe+2Fe
3+=3Fe
2+,故答案为:3NH
3?H
2O+Al
3+=Al(OH)
3↓+3NH
4+;Fe+2Fe
3+=3Fe
2+;
(3)A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34.退单戊为H
2O
2,己为H
2S,其中戊的熔沸点高于己,是因为过氧化氢分子间存在氢键,
故答案为:H
2O
2分子间存在氢键;
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐,结合元素化合价代数和为0,由A为H、B为N、C为O、E为S、F为Fe元素组成的一种具有还原性的复盐,说明含有亚铁离子和铵根离子,复盐的化学式NH
4)
2Fe(SO
4)
2或(NH
4)
2Fe(SO
4)
2?6H
2O或(NH
4)
2SO
4?FeSO
4?6H
2O;将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体,反应的化学方程式为;(NH
4)
2SO
4+FeSO
4+6H
2O=(NH
4)
2Fe(SO
4)
2?6H
2O;析出该复盐晶体的原理,是利用硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多的特征从溶液中析出晶体;
故答案为:(NH
4)
2Fe(SO
4)
2或(NH
4)
2Fe(SO
4)
2?6H
2O或(NH
4)
2SO
4?FeSO
4?6H
2O;(NH
4)
2SO
4+FeSO
4+6H
2O=(NH
4)
2Fe(SO
4)
2?6H
2O;硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多.
分析:A元素原子核内只有一个质子判断为H,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L
-1,计算得到气体摩尔质量=22.4L/mol×0.759g?L
-1=17g/mol;推断为NH
3,B为N,C元素原子的最外层电子数是其电子层数的3倍判断C为O,E与C同主族判断E为S;元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素判断为Al、Fe;依据推断元素分析回答.
点评:本题考查了无机物推断方法、原子结构的分析利用和转化关系的判断应用,物质性质和反应特征,反应现象是解题关键,题目难度中等.

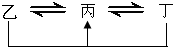 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题: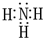 ,故答案为:
,故答案为: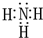 ;
;

 全优点练单元计划系列答案
全优点练单元计划系列答案 短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.
短周期元素A、B、C、D、E、F原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族:E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.