
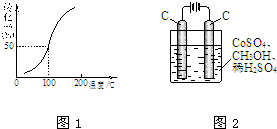
 甲醇可作电池的原料,也会造成环境污染.请根据有关反应回答问题.
甲醇可作电池的原料,也会造成环境污染.请根据有关反应回答问题.| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
| △C |
| △t |
| 1 |
| 2 |
| ||
| 5min |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、氯化钠 食盐 NaCl2 |
| B、碳酸氢钠 纯碱 NaHCO3 |
| C、氢氧化钙 熟石灰 CaO |
| D、氢氧化钠 烧碱 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 可简写为
可简写为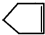 ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: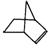
查看答案和解析>>
科目:高中化学 来源: 题型:
| C% | H% | O% |
| 40.00% | 6.67% | 53.33% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从700℃到900℃,平衡体系中气体的密度变大 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
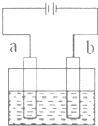
| A、b电极上发生氧化反应 |
| B、该装置能将化学能转变成电能 |
| C、电解质溶液中Cl-向a电极迁移 |
| D、若b为铁,则b电极的反应式为:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
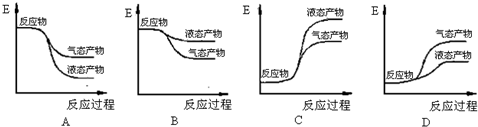
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| B、用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定不含K+ |
| C、将某气体通入溴水中,溴水颜色褪去,该气体一定是SO2 |
| D、向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯和丙烷可用Br2的CCl4溶液来区别 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、米酒变酸的过程涉及了氧化反应 |
| D、石油分馏和石油的裂化都属于化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com