
����Ŀ��ij��ѧ������ȤС��̽��ͭ��Ũ����ķ�Ӧ������ף��ң�����λͬѧ����������ʵ�飺ȡ12.8gͭƬ��20ml��18mol/L��Ũ�������Բ����ƿ�й��ȣ�ֱ����Ӧ��ϣ��������ƿ�л���ͭƬʣ���⣬ͬʱ������ѧ��֪ʶ��Ϊ���н϶������ʣ�࣮
��1����д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ�� ��
���ʣ�Ϊʲô�϶���������ͭƬ������Ӧ���������ɣ� ��
����֤���������ʵ�鷽���� ����д��ĸ����ѡ���ѡ�۷֣���
a���ټ������� b���ٵ���BaCl2��Һ
c���ټ����� d���ٵ���Na2CO3��Һ
��2����ѧ�����������Ũ�ȵ�ʵ�鷽���Dzⶨ��������������䷽���ж��֣��������з����в����е��� ����д��ĸ����ѡ���ѡ�۷֣���
a�������������建��ͨ��Ԥ�ȳ���ʢ�м�ʯ�ҵĸ���ܣ�������Ӧ���ٴγ�����
b�������������建��ͨ�����Ը��������Һ���ټ�������BaCl2��Һ�����ˡ�ϴ�ӡ��������������
c������ˮ���ⶨ�������������������ɱ�״������
d�����ű���NaHSO3��Һ�ķ�������������������������ɱ�״������
��3����ͬѧ��Ʋⶨ����Ũ�ȵ�ʵ�鷽���ǣ��ⶨ��Ӧ��Ļ��Һ��Cu2+�������ڷ�Ӧ�����Һ�м�����ˮϡ����100ml����������Na2S��Һ����ַ�Ӧ���ˣ�ϴ�ӣ����������������д�����ɳ��������ӷ���ʽ�� ��
��4�����ݼס�����ͬѧ��ʵ�鷽���������������������ʵ�����Ӧ����ͭ�����ʵ����⣬��ȱ�ٵIJ��������� ��
��5����ͬѧ����ס�����ͬѧ��ʵ�鷽����Ƶĸ��ӣ�Ϊ������������н�Ϊ����ʵ�鷽����ȡ����Ӧ���ͭƬ������ϴ�ӣ�������������Ƶ�ʣ��ͭƬ������ΪWg����÷�Ӧ����Һ�����ΪVml�������ʣ����������ʵ���Ũ��= mol/L���ú�W��V�Ĵ���ʽ��ʾ��
���𰸡���1��Cu+2H2SO4��Ũ��![]() CuSO4+2H2O+SO2����ͭƬ���������ᷴӦ����Һ��ϡ��֧�ַ�Ӧ��
CuSO4+2H2O+SO2����ͭƬ���������ᷴӦ����Һ��ϡ��֧�ַ�Ӧ��
ad����2��ac����3��Cu2++S2��=CuS������4����Ӧ����Һ���������5��![]() ��
��
��������
�����������1��Ũ������ǿ�����ԣ��ɽ�ͭ������ϡ������ǿ�����ԣ�������ͭ��Ӧ�����ݽ�����ͨ�ԣ�
������������ý���������Ӧ�������������ɣ���˵���������ʹû��������Һ��Ҳ����������������Ȼ�����Ӧ���ɳ�����ϡ������������Ӧ������������̼���η�Ӧ��������ʹ�����ʯ��ˮ����ǵ��������ɣ���˵���������2����ʯ�������ն��������ˮ���ʲ��ܲ�������������������������������ˮ����������ˮ�����������3��Cu2+��S2����Ӧ���ɺ�ɫ��������4�����ʵ���Ũ�ȵ�����Һ�����ʵ����ʵ������ʵ���������Һ�������ȱ����Һ���������5����Ӧ��ͭ�����ʵ���=
![]() ����Ӧ������������ʵ�����ͭ�Ķ�����Ϊ
����Ӧ������������ʵ�����ͭ�Ķ�����Ϊ![]() �����ܵ���������ʵ�����ȥ��Ӧ�ľ���ʣ��ģ�Ϊ0.36��
�����ܵ���������ʵ�����ȥ��Ӧ�ľ���ʣ��ģ�Ϊ0.36��![]() ��Ȼ��������ʵ���Ũ�ȵ�����Һ�����ʵ����ʵ������ʵ���������Һ��������������
��Ȼ��������ʵ���Ũ�ȵ�����Һ�����ʵ����ʵ������ʵ���������Һ��������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����7gijCu��Ag�Ͻ���һ������Ũ���ᷴӦ���Ͻ���ȫ�ܽ��ų����������״����0.56L������Ϻ�ͨ��ˮ��ǡ����ȫ�����գ���Ͻ���ͭ������Ϊ
A. 1.6g B. 2.4g C. 3.2g D. 4.8g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����Ч�������������ػ�����ȡ��ʩ���ƴ����������о�����Ч���ƿ����еĵ������ﺬ����ʹ�������Դ�Ե���Ϊ��Ҫ��
��1����֪��4NH3(g)��5O2(g)![]() 4NO(g)��6H2O(g) H = -905.48 kJ��mol-1
4NO(g)��6H2O(g) H = -905.48 kJ��mol-1
N2(g)��O2(g)![]() 2NO(g) H = +180.50 kJ��mol-1
2NO(g) H = +180.50 kJ��mol-1
��4NH3(g)��6NO(g)![]() 5N2(g)��6H2O(g)��H = ��
5N2(g)��6H2O(g)��H = ��
��2��ij��ѧС���������֪2NO(g)+O2(g)![]() 2NO2(g)�ķ�Ӧ���̷�������
2NO2(g)�ķ�Ӧ���̷�������
��һ����2NO(g)![]() N2O2(g) ������ H1<0 v1��=k1��c2(NO) ��v1��=k1��c(N2O2)
N2O2(g) ������ H1<0 v1��=k1��c2(NO) ��v1��=k1��c(N2O2)
�ڶ�����N2O2(g)��O2(g)![]() 2NO2(g) ������ H2< 0
2NO2(g) ������ H2< 0
v2��=k2��c(N2O2)c(O2)��v2��=k2��c2(NO2)
�� 2NO(g)��O2(g)![]() 2NO2(g)����Ӧ������Ҫ����_______��������һ���������ڶ���������Ӧ������
2NO2(g)����Ӧ������Ҫ����_______��������һ���������ڶ���������Ӧ������
�� һ���¶�������Ӧ2NO(g)��O2(g)![]() 2NO2(g)�ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK= �������¶���Kֵ ������������������ С��������������
2NO2(g)�ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK= �������¶���Kֵ ������������������ С��������������
��3�����û���̿Ϳ�������ܴ���NOx�ķ�ӦΪ��xC(s)��2NOx(g)![]() N2(g)��xCO2(g) ��H <0�����������ʵ������������������ڱ�Ϊ����̿Ϳ��������______����������������������ʹNOx������Ч��ת��Ϊ��β�����ŷţ���ԭ���� ��
N2(g)��xCO2(g) ��H <0�����������ʵ������������������ڱ�Ϊ����̿Ϳ��������______����������������������ʹNOx������Ч��ת��Ϊ��β�����ŷţ���ԭ���� ��
��4��һ������CO2��������̼������ɱ�ĺ�ѹ�ܱ������з�Ӧ�� C(s)��CO2(g)![]() 2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ����800��ʱ����Ӧ��ƽ��ʱCO2��ת����Ϊ________������һλС������
2CO(g)��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ��ͼ��ʾ����800��ʱ����Ӧ��ƽ��ʱCO2��ת����Ϊ________������һλС������

��5��������һ����Ҫ�������Դ��Mg2Cu��һ�ִ���Ͻ�350��ʱ��Mg2Cu��H2��Ӧ������MgCu2�ͽ���һ�ֽ���Ԫ�ص��⻯����������������Ϊ0.077����Mg2Cu��H2��Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪W��X��Y��ZΪ������Ԫ�أ�ԭ��������������W��Zͬ���壬X��Y��Z
ͬ���ڣ�����ֻ��XΪ����Ԫ�ء�����˵��һ����ȷ����
A��ԭ�Ӱ뾶��X��Y��Z��W
B��W�ĺ���������Ա�Z�ĺ����������ǿ
C��W����̬�⻯����ȶ���С��Y����̬�⻯����ȶ���
D����W��Xԭ��������Ϊ5�����γɻ�����Ļ�ѧʽΪX3W2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У��������
A�����ǡ����ۡ���ά��ˮ������ղ��ﶼֻ��������
B������ؽ����Σ���������ţ�̻��ɽⶾ
C����֬�������������������࣬������ͬϵ��
D��ú�ĸ�����Եõ������ױ��ȷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ᡢ�����������������أ������������ʵ�����һ�µ���
��� | �������ʵ | ���� |
A | SiO2+Na2CO3 | ���ԣ�H2SiO3>H2CO3 |
B | 2Mg+CO2 | ��ԭ�ԣ�Mg>C |
C | Ư�����ڿ����з���ʱ����ö����� | Ư���е�CaCl2������е�CO2��Ӧ����̼��� |
D | �����Ȼ�����Һ��������ͭ��ӡˢ��·�� | FeCl3��Һ�û���ͭ���� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4 mol A�����2 mol B������2 L�������л�ϣ�����һ�������·������·�Ӧ��2A��g����B��g��![]() 2C��g������2 s����C��Ũ��Ϊ0.6 mol��L��1���������м���˵����
2C��g������2 s����C��Ũ��Ϊ0.6 mol��L��1���������м���˵����
��������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3 mol��L��1��s��1
��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6 mol��L��1��s��1
��2 sʱ����A��ת����Ϊ70%
��2 sʱ����B��Ũ��Ϊ0.7 mol��L��1��������ȷ����
A���٢� B���٢� C���ڢ� D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʺϵ�����������Ӧ2Fe3+��2I��![]() 2Fe2+��I2��Ƴ���ͼ��ʾ��ԭ��ء������ж�����ȷ���ǣ� ��
2Fe2+��I2��Ƴ���ͼ��ʾ��ԭ��ء������ж�����ȷ���ǣ� ��
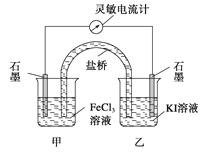
A����Ӧ��ʼʱ������ʯī�缫�Ϸ���������Ӧ
B����Ӧ��ʼʱ������ʯī�缫�ϵ�Fe3������ԭ
C�������ƶ���Ϊ��ʱ����Ӧ�ﵽ��ѧƽ��״̬
D�������ƶ���Ϊ����ڼ�������FeCl2���壬���е�ʯī�缫Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѡ��5���л���ѧ������������E��һ��ҽҩ�м��壬�������Ʊ�����Ѫҩ������ͨ����ͼ��ʾ��·�ߺϳɣ�

��1��E�еĺ�������������Ϊ ��
��2��Bת��ΪC�ķ�Ӧ������ ��
��3��д��D������NaOH��Һ��ȫ��Ӧ�Ļ�ѧ����ʽ ��
��4��1molE������ molH2�ӳɡ�
��5��д��ͬʱ��������������B��һ��ͬ���칹��Ľṹ��ʽ ��
A��������ֻ������ȡ�������ҳ���������������״�ṹ
B���˴Ź�������ֻ��4����
C������FeCl3��Һ������ɫ��Ӧ
��6����֪�����ǻ�һ�㲻��ֱ���������������ױ��ɱ����Ը��������Һ����Ϊ�����ᡣ�Բ������ºͳ�·��ͼʾ��д���Ա��ӡ��ױ�Ϊԭ����ȡ�����ᱽ����(![]() )�ĺϳ�·��(��ԭ����ѡ)���ϳ�·������ͼʾ�����£�
)�ĺϳ�·��(��ԭ����ѡ)���ϳ�·������ͼʾ�����£�![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com