
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9. 6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
| A. | ①的上层清液中含有Fe2+、Fe3+、Cu2+ | |
| B. | 硝酸的浓度为1mol•L-1 | |
| C. | 每份混合物中铁粉的质量为16.8g | |
| D. | ④中V=11.2L |
分析 A.由表中数据可知,实验①②都有金属剩余,根据实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O分析解答;
B.实验①硝酸全部反应,根据c=$\frac{n}{V}$计算硝酸的物质的量浓度;
C.由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为$\frac{0.1mol×(5-2)}{2}$=0.15mol,参加反应金属的平均摩尔质量为$\frac{8.4g}{0.15mol}$=56g/mol,故该过程只有Fe参加反应,故实验①只有Fe参与反应,根据NO的体积结合方程式计算参加反应Fe的物质的量;根据m=nM计算①中参加反应Fe的质量;
D.实验②中Fe与硝酸恰好反应生成硝酸亚铁,在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,溶液中亚铁离子的物质的量为0.3mol,根据电子转移守恒和据V=nVm计算生成的气体体积.
解答 解:由表中数据可知,实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4480mL-2240mL=2240mL,NO物质的量为0.1mol,根据电子转移守恒可知,参加反应金属的物质的量为$\frac{0.1mol×(5-2)}{2}$=0.15mol,参加反应金属的平均摩尔质量为 $\frac{8.4g}{0.15mol}$=56g/mol,故该过程只有Fe参加反应,故实验①只有Fe参与反应;
在实验②的基础上加入100mL硝酸,参加反应的金属的质量为9.6g,生成NO的体积为6720mL-4480mL=2240mL,NO物质的量为0.1mol,若该过程只有Cu参加反应,根据电子转移守恒,则Cu的物质的量=$\frac{0.1mol×(5-2)}{2}$=0.15mol,Cu的质量=0.15mol×64g/mol=9.6g,等于参加反应金属的质量,故该过程只有Cu反应,且Cu恰好完全反应,故加入200mL硝酸时,Fe恰好反应生成硝酸亚铁,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,
A.实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,硝酸量不足,金属过量,所以不可能有Fe3+、Cu2+,故A错误;
B.实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,根据方程式可知,参加反应的硝酸的物质的量为0.1mol×4=0.4mol,故硝酸的物质的量浓度为:c=$\frac{0.4mol}{0.1L}$=4mol/L,故B错误;
C.由上述分析可知,实验①发生反应3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O,生成NO的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,根据方程式可知,参加反应的Fe的物质的量为0.1mol×$\frac{3}{2}$=0.15mol,故参加反应Fe的质量=0.15mol×56g/mol=8.4g,所以每份混合物中铁粉的质量为8.4g×2=16.8g,故C正确;
D.由上述分析可知,实验②中Fe与硝酸恰好反应生成硝酸亚铁,生成NO的物质的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,由3Fe+8HNO3═3Fe(NO3)2+2NO↑+4H2O可知,溶液中亚铁离子的物质的量为0.3mol,在实验③的基础上再加入100mL硝酸,为硝酸与溶液中亚铁离子反应生成NO,根据电子转移守恒可知,生成NO的物质的量为:$\frac{0.3mol×(3-2)}{5-2}$=0.1mol,故生成NO的体积为:0.1mol×22.4L/mol=2.24L,则V=6.72L+2.24L=8.96L,故D错误;
故选C.
点评 本题考查混合物的有关计算,根据表中数据判断各阶段发生的反应是解题关键,侧重对学生综合能力的考查,本题过程复杂、计算量较大,为易错题目,难度较大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单氢化物的沸点:Z>W | |
| B. | 由W、Y两种元素形成的化合物一定不含共价键 | |
| C. | 简单气态氢化物的热稳定性:X>W | |
| D. | 元素Y和Z的简单离子具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
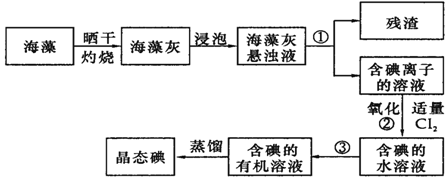
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中Fe2+和Fe3+至少有一种,一定没有SiO32-、Ag+ | |
| B. | 步骤Ⅱ中无色气体可能含有CO2,原溶液中可能含有CO32- | |
| C. | 原溶液中肯定含有Cl-、Mg2+ | |
| D. | 为确定是否含有Cl-,可取原溶液加入少量硝酸银和稀硝酸,观察是否产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜是我国使用最早的合金 | |
| B. | 光导纤维做通讯材料有许多优点,但怕腐蚀,铺设也很不方便 | |
| C. | 高温结构陶瓷比金属材料具有许多优点,如不怕氧化、密度小等优点 | |
| D. | 光导纤维除用于通讯外,还可以用于医疗、信息处理等许多方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变黄色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3- | |
| C. | 无色溶液:Al+、Cl-、SO42-、NO3- | |
| D. | C(H2C2O4)=0.1mol/L溶液:Na+、MnO4-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com