
 CuSO4+SO2↑+H2O,2molH2SO4的浓硫酸完全反应可生成1molSO2,但铜与稀硫酸不反应,则随反应的进行,浓硫酸变为稀硫酸,生成SO2分子总数小于NA个,故B错误;
CuSO4+SO2↑+H2O,2molH2SO4的浓硫酸完全反应可生成1molSO2,但铜与稀硫酸不反应,则随反应的进行,浓硫酸变为稀硫酸,生成SO2分子总数小于NA个,故B错误;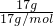 =1mol,质子的物质的量为1mol×(8+1)=9mol,17gH2O2的物质的量为
=1mol,质子的物质的量为1mol×(8+1)=9mol,17gH2O2的物质的量为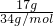 =0.5mol,其质子的物质的量为0.5mol×(1×2+8×2)=9mol,则17g羟基与17gH2O2所含质子数均为9NA,故C正确;
=0.5mol,其质子的物质的量为0.5mol×(1×2+8×2)=9mol,则17g羟基与17gH2O2所含质子数均为9NA,故C正确;

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com