
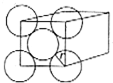
 金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:
金晶体是面心立方最密堆积,立方体的每个面上5个金原子紧密堆砌(如图,其余各面省略),金原子半径为A cm,求:分析 (1)金原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$,每个金晶胞中含有4个原子,金晶体的边长a=$\root{3}{\frac{4M}{N{\;}_{A}•ρ}}$;再根据晶胞的边长计算其对角线长度,对角线长度就是金原子半径的4倍,半径已知,即可求出密度;
(2)计算金原子的总体积与晶胞总体积的比值.
解答 解:(1)金原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$,每个金晶胞中含有4个原子,金晶体的边长a=$\root{3}{\frac{4M}{N{\;}_{A}•ρ}}$;对角线长度就是金原子半径的4倍,金原子半径为A cm,再由晶胞的边长计算其对角线长度,所以a2+a2=(4r)2,即($\root{3}{\frac{4M}{N{\;}_{A}•ρ}}$)2+($\root{3}{\frac{4M}{N{\;}_{A}•ρ}}$)2=(4A)2,解得:ρ=$\frac{4×197}{(2\sqrt{2}A){\;}^{3}{N}_{A}}$g•cm-3;
故答案为:$\frac{4×197}{(2\sqrt{2}A){\;}^{3}{N}_{A}}$;
(2)该晶胞为面心立方最密堆积,则晶胞面对角线为金原子半径的4倍,金原子半径为Acm,晶胞的边长为4Acm×$\frac{\sqrt{2}}{2}$=2$\sqrt{2}$Acm,每个金晶胞中含有4个原子,则金原子总体积为4×$\frac{4}{3}$πA3cm3,晶胞体积为(2$\sqrt{2}$Acm)3,故空间利用率为$\frac{4×\frac{4}{3}π{A}^{3}c{m}^{3}}{(2\sqrt{2}A)^{3}}$×100%=$\frac{4×\frac{4}{3}π}{(2\sqrt{2})^{3}}$×100%;
故答案为:$\frac{4×\frac{4}{3}π}{(2\sqrt{2})^{3}}$×100%.
点评 本题考查晶胞计算、晶胞密度计算以及空间利用率的计算,难度不大,注意晶胞的边长不是金原子直径,为易错点.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
 在5-氨基四唑(
在5-氨基四唑(  )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
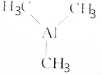 )可用于金属有机化合物气相沉积,下列有关说法正确的是( )
)可用于金属有机化合物气相沉积,下列有关说法正确的是( )| A. | 三甲基铝的摩尔质量是72 | |
| B. | 14.4g三甲基铝中碳原子数为0.6NA | |
| C. | 0.5mol三甲基铝的质量为36g•mol-1 | |
| D. | 1mol三甲基铝在标准状况下的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
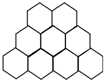 石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合.据图分析,石墨晶体中碳原子数与共价键数之比为( )
石墨晶体是层状结构,在每一层内,每个碳原子都跟其他3个碳原子相结合.据图分析,石墨晶体中碳原子数与共价键数之比为( )| A. | 3:2 | B. | 2:1 | C. | 1:3 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下$\frac{c({H}^{+})}{c({OH}^{-})}$=1012的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 含有大量Al3+的溶液中:Na+、NH4+、Cl-、HCO3- | |
| C. | 能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br- | |
| D. | 常温下,由水电离出的c(H+)=1×10-13 mol•L-1的溶液中:K+、Fe3+、CH3COO-、SO42-电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com