
分析 (1)在阳离子中,核电荷数=质子数=核外电子数+所带电荷数;
(2)质量数=质子数+中子数;
(3)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为m-x+2,计算出n克A2-离子的物质的量,则可计算电子个数;
(4)由Cl-+Ag+═AgCl↓计算XCl2的物质的量,再由M=$\frac{m}{n}$计算其摩尔质量,摩尔质量与相对分子质量的数值相等,原子的质量数为原子的近似相对原子质量,结合该原子原子核内有20个中子,根据质子数=质量数-中子数来计算原子的质子数,利用质子数确定元素在周期表中的位置.
解答 解:(1)根据在阳离子中:核电荷数=质子数=核外电子数+所带电荷数,即核电荷数=质子数=x+n,又根据质量数=质子数+中子数,即中子数=质量数-质子数=A-(x+n),故答案为:A-x-n;
(2)12C中中子数为12-6=6,18O中中子数为18-8=10,所以12C18O2分子中,中子数为6+10×2=26,故答案为:26;
(3)元素A的质量数为m,A2-离子的原子核内有x个中子,则A的质子数为m-x,所以A2-中核外电子数为:m-x+2,
n(A2-)=$\frac{n}{m}$mol,则n克A2-离子中包含电子个数是$\frac{n}{m}$mol×(m-x+2)×NA/mol=$\frac{n}{m}$(m-x+2)mol;
故答案为:$\frac{n}{m}$(m-x+2);
(4)①由Cl-+Ag+═AgCl↓可知,n(Cl-)=n(Ag+)=0.02L×1mol/L=0.02mol,
n(XCl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.02mol=0.01mol,
则M(XCl2)=$\frac{1.11g}{0.01mol}$=111g/mol,
所以XCl2相对分子质量为111,
所以X的相对原子质量=111-35.5×2=40,即X的质量数为40,
质子数=质量数-中子数=40-20=20,即Z=20,A=40
故答案为:20;40;
②X为Ca,位于第四周期第ⅡA族,故答案为:第四周期第ⅡA族.
点评 本题考查了原子结构以及元素周期表的结构及应用,题目难度不大,注意把握:在阳离子中,核电荷数=质子数=核外电子数+所带电荷数,在阴离子中:核电荷数=质子数=核外电子数-所带电荷数.


科目:高中化学 来源: 题型:实验题
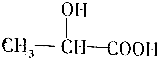 ,
,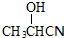 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
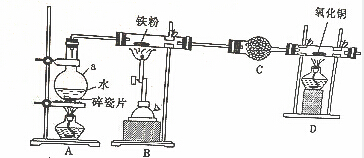
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4甲基4,5二乙基己烷 | B. | 2,3-二甲基-2,4-戊二烯 | ||
| C. | CH3CH(OH)CH2CH3:丁醇 | D. | 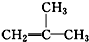 :2-甲基-1-丙烯 :2-甲基-1-丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为: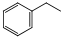 (g)$?_{高温(T)}^{Fe_{2}O_{3}}$
(g)$?_{高温(T)}^{Fe_{2}O_{3}}$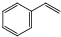 (g)+H2(g)△H=+120kJ•mol-1
(g)+H2(g)△H=+120kJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com