
分析 (1)硫酸氢钠与氢氧化钠反应生成硫酸钠和水,反应实质为氢离子与氢氧根离子反应生成水;
(2)碳酸氢钠与盐酸反应的实质为碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
(3)反应生成醋酸钠和水,醋酸和水在离子反应中应保留化学式;
(4)铁与稀硫酸反应生成硫酸亚铁和氢气.
解答 解:(1)硫酸氢钠在溶液中完全电离出钠离子、氢离子和硫酸根离子,二者反应的离子方程式为:OH-+H+=H2O,
故答案为:OH-+H+=H2O;
(2)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,离子反应为:H++HCO3-=H2O+CO2↑,
故答案为:H++HCO3-=H2O+CO2↑;
(3)醋酸(CH3COOH)和氢氧化钠溶液反应生成醋酸钠和水,该离子反应为CH3COOH+OH-=CH3COO-+H2O,
故答案为:CH3COOH+OH-=CH3COO-+H2O;
(4)铁和稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑.
点评 本题考查离子反应方程式的书写,题目难度中等,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法即可解答,试题培养了学生的灵活应用能力.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:解答题
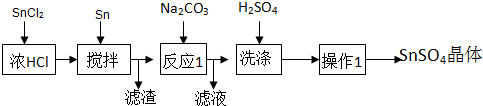
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10mL量筒量取8.58mL蒸馏水 | |
| C. | 制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 非标准状况下,1mol任何气体不可能占有22.4L体积 | |
| C. | 0.4.molH2、0.2molO2、和0.4molCO2组成的混合气体,在标准状况下约为22.4L | |
| D. | 同温、同压下,相同质量的CO和CO2具有相同的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
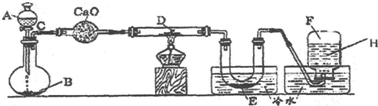
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  向容量瓶中转移溶液 | B. |  中和热的测定 | ||
| C. |  浓硫酸与铜的反应 | D. |  乙二酸晶体受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 高压对合成氨有利 | |
| C. | 将NO2和N2O4的混合气体降温后,气体颜色变浅 | |
| D. | 加入催化剂能使合成氨的速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室配制500mL 0.2mol.L-1Na2S04溶液,实验操作步骤如下:
实验室配制500mL 0.2mol.L-1Na2S04溶液,实验操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com