
 2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )
2CO(g) ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 ( )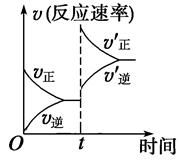
| A.①②③④ | B.①③ | C.①② | D.①③④ |
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:不详 题型:填空题

| 编号 | 电极材料 | 电解质溶液 | 电子流动方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
| A.T1时,v正>v逆 |
| B.正反应的△H<0 |
| C.a、b两点的反应速率va=vb |
| D.T<T1时,ω增大的原因是平衡向正方向移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+C(g)△H>0达平衡时,要使v(正)降低,A的浓度增大,应采取的措施是( )
2B(g)+C(g)△H>0达平衡时,要使v(正)降低,A的浓度增大,应采取的措施是( )| A.加压 | B.减压 | C.减小C的浓度 | D.降温 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml) | 5 | 11 | 7 | 8 | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 粗颗粒大理石 | |
| ② | 常温 | 粗颗粒大理石 | 2.0 |
| ③ | | 粗颗粒大理石 | 2.0 |
| ④ | 常温 | | 2.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com