
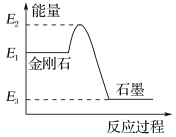
【题目】(1)我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:3SiO2+6C+2N2![]() Si3N4+6CO,该反应变化过程中的能量变化如图所示。
Si3N4+6CO,该反应变化过程中的能量变化如图所示。

回答以下问题。
(1)该反应________(填“吸热”或“放热”),反应热ΔH________0(填“>”、“<”或“=”)。
(2)已知:
As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+![]() O2(g)=As2O5(s) ΔH3
O2(g)=As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=__________。
(3)氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。已知:
①2NO(g)=N2(g)+O2(g) ΔH=-180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
某反应的平衡常数表达式为K=![]() ,写出此反应的热化学方程式:____________。
,写出此反应的热化学方程式:____________。
(4)甲烷的燃烧热为890.3 kJ/ mol ,请写出表示CH4燃烧热的热化学方程式_____________。
(5)由图可知,金刚石的稳定性________石墨的稳定性(填“>”、“<”或“=”)。
(6)中和热的测定装置如图所示:
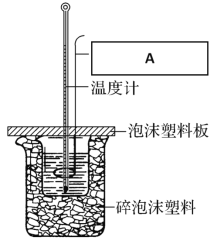
图中A的仪器名称:__________________作用:____________________________
【答案】放热 < 2ΔH1-3ΔH2-ΔH3 2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1 小于 环形玻璃搅拌棒 搅拌使其充分反应
【解析】
根据反应前后物质所含能量的大小关系可分析出反应吸放热类型;根据盖斯定律,通过其他焓变已知的热化学方程式即可计算未知反应的焓变;根据平衡常数表达式可书写出相应的反应方程式,再根据盖斯定律借助其他焓变已知的热化学方程式即可计算未知反应的焓变;书写表示燃烧热的热化学方程式时,一定要注意燃烧热的定义;根据物质所含能量的多少,即可判断物质的稳定性;在测定中和热的实验中,用到的最为特别的仪器即为环形玻璃搅拌棒,一方面要注意该仪器的材质为玻璃,另一方面注意该仪器并非普通的玻璃搅拌棒,但作用几乎等同。
(1)由图可知,反应物的能量更高,因此该反应是放热反应,![]() ;
;
(2)由题可知,方程式Ⅳ:![]() 可由方程式Ⅰ:
可由方程式Ⅰ:![]() 和方程式Ⅱ:
和方程式Ⅱ:![]() 以及方程式Ⅲ:
以及方程式Ⅲ:![]() ,经过如下运算得到:Ⅳ=2Ⅰ-3Ⅱ-Ⅲ;因此其焓变可表示为:
,经过如下运算得到:Ⅳ=2Ⅰ-3Ⅱ-Ⅲ;因此其焓变可表示为:![]() ;
;
(3)由平衡常数表达式可知,该反应的方程式为④:![]() ;其可由方程式①②③经过如下运算得到:④=①-③+2②,即方程式④的焓变可表示为ΔH4=ΔH1-ΔH3+2ΔH2,代入数据计算可得该反应焓变为-746.5kJ/mol,因此该反应的热化学方程式为:
;其可由方程式①②③经过如下运算得到:④=①-③+2②,即方程式④的焓变可表示为ΔH4=ΔH1-ΔH3+2ΔH2,代入数据计算可得该反应焓变为-746.5kJ/mol,因此该反应的热化学方程式为:![]()
![]() ;
;
(4)甲烷的燃烧热为890.3kJ/mol,即1mol甲烷完全燃烧生成CO2和液态水会放出890.3kJ的热量,所以表示甲烷燃烧热的热化学方程式为:![]()
![]() ;
;
(5)由图可知,金刚石所含的能量更高,所含能量越高的物质越不稳定,因此金刚石稳定性小于石墨的稳定性;
(6)在测定中和热的实验中,使用的A是环形玻璃搅拌棒,其作用即搅拌溶液使酸与碱能充分反应。


科目:高中化学 来源: 题型:
【题目】Ⅰ.一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。
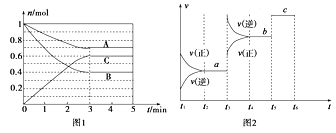
(1)该反应的化学方程式为____________________________。
(2)该反应的反应速率v随时间t的关系如上图2所示:
①根据上图判断,在t3时刻改变的外界条件是______________。
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的大小关系为________(用“>”、“<”或“=”连接)。
Ⅱ.在密闭容器中充入一定量的H2S,发生反应2H2S(g) ![]() 2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH,如图所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
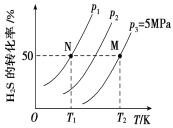
(1)△H_________ (填“>”“<”或“ = ”)0。
(2)图中压强(p1、p2、p3)的大小顺序为________________。
(3)图中M点的平衡常数Kp =_______MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:
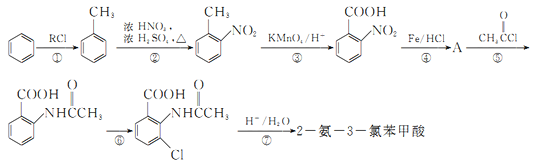
已知: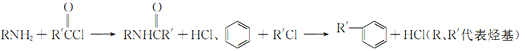
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。
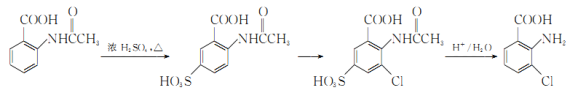
分析产率提高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中加入CaSO4和CO,在一定温度下,发生反应:CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1
CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1

CO的反应速率随时间变化如图所示。下列说法正确的是( )
A.该反应是吸热反应,升高温度,正反应速率增大,逆反应速率减小
B.CaO是固态,不能用CaO表示反应的快慢
C.图示中t1时改变的条件可能是减小c(CO),同时增大c(SO2)
D.图示中t1时改变的条件可能是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚![]() ,其原理如图所示,下列说法不正确的是
,其原理如图所示,下列说法不正确的是
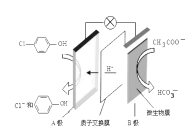
A.电流方向从B极沿导线经小灯泡流向A极
B.A为电池的正极,发生还原反应
C.A极的电极反应式为:![]()
D.当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、实验现象和相应结论都正确的是
实验 | 现象 | 结论 | |
A | 向1mL | 溶液分层,上层溶液显紫色。 | 氧化性:Fe3+>I2 |
B | 将两块表面积相等的Mg条和Al条放入同浓度同体积的NaOH溶液中。 | Al条产生气泡的速度快。 | 金属性:Al>Mg |
C | 向烧杯中加入一定体积蒸馏水,加热至沸腾时,向其中逐滴滴加饱和FeCl3溶液。 | 得到红褐色透明液体。 | 制得了氢氧化铁胶体。 |
D | 向盛有10 mL溴水的分液漏斗中加入10mL苯,振荡、静置。 | 溶液分为两层,上层为橙色。 | 溴在苯中的溶解能力大于水中。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
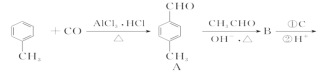

已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液呈紫色且苯环上有两个取代基的A的同分异构体有_____________种,A中含官能团的名称为_______________________。
(2)试剂C可选用下列中的_________________。
a.溴水
b. 银氨溶液
c.酸性KMnO4溶液
d.新制Cu(OH)2悬浊液
(3) 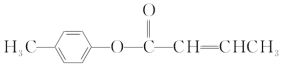 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________________________________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________________________________________________。
(4)D的分子式为______________,由D→E的反应类型是_________________,E在一定条件下可以生成高聚物F,F的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 某溶液中可能存在
某溶液中可能存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等7种离子中的某几种,分别进行如下实验:
等7种离子中的某几种,分别进行如下实验:
![]() 向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
![]() 向所得橙色溶液中加入足量
向所得橙色溶液中加入足量![]() 溶液,无沉淀生成;
溶液,无沉淀生成;
![]() 向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
则下列说法正确的是![]()
A.肯定没有![]() B.肯定有
B.肯定有![]() 、
、![]()
C.可能有![]() D.可能有
D.可能有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com