利用海水脱硫是处理火力发电排放出SO
2的一种有效的方法,其工艺流如图所示:
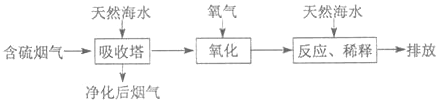
(1)天然海水呈碱性,写出SO
2与OH
-反应的离子方程式
.
(2)天然海水吸收了含硫烟气后会溶有H
2SO
3分子,使用氧气将其氧化的化学原理是
(用化学方程式表示).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是
.
(3)为了测定炉气中SO
2的体积百分含量,把500mL的炉气通入20mL 0.05mol/L的高锰酸钾溶液中,恰好使紫色刚好褪去.请回答:
①配平方程式:
KMnO
4-+
SO
2+
H
2O═
Mn
2++
SO
42-+
②测定结果炉气中SO
2的含量为
.
(4)已知工业上利用可逆反应2SO
2+O
2 2SO
3,△H<0,来制备硫酸,下列对该反应的说法正确的是
.
A.当单位时间内消耗2mol SO
2的同时生成2mol SO
3,说明该反应达到平衡
B.升高温度,可以增大正反应速率
C.恒容,通入氩气增大压强,促使平衡向右移动
D.工业上通过鼓入大量的空气而提高SO
2的转化率
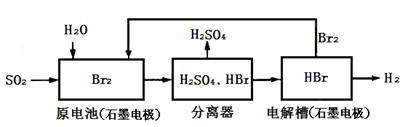
(5)某科研小组利用SO
2、O
2和稀H
2SO
4设计成原电池,该电池的负极反应为:
.