
【题目】常温下,电解质溶液中的下列关系式不正确的是( )
A.0.1molL-1 CH3COOH溶液加水稀释,n(H+)增大
B.在0.1molL-1的氨水中滴加0.1molL-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=10-amolL﹣1
C.将cmolL-1的醋酸溶液与0.02molL-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=![]()
D.已知A-+H2B(过量)═HA+HB-,则结合H+的能力:A-<HB-<B2-
【答案】D
【解析】
根据题中电解质溶液可知,本题考查弱电解质的电离平衡及电离平衡常数,运用影响电离平衡规律和电离平衡常数计算公式分析。
A. 0.1molL-1 CH3COOH溶液加水稀释,促进醋酸电离,n(H+)增大,A项正确;
B.在0.1mol·L-1氨水中滴加0.1mol·L-1盐酸,刚好完全中和生成氯化铵,铵根离子水解促进了水的电离,此时pH=a,则溶液中水电离的(OH-)=c(H+)=10-amol·L-1,B项正确;
C.反应后溶液呈中性,则(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=0.01 mo/L,根据物料守恒,反应后溶液中醋酸的浓度为:(![]() -0.01)mo/L,所以用含c的代数式表示CH3COOH的电离常数为:Ka=
-0.01)mo/L,所以用含c的代数式表示CH3COOH的电离常数为:Ka=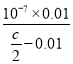 =
=![]() , C项正确;
, C项正确;
D.酸性:H2B>HB->HA,酸性越强,其阴离子结合质子的能力越弱,则A->B2-->HB-,D项错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理”的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的电子排布式是[Ar] __。氮化镓是一种新型材料,可把手机信号放大10倍,氮化镓的功效与电子跃迁有关,而元素的光谱也与电子的跃迁有关。下列变化过程不会产生原子光谱的是__(填字母序号)。
A.[Ar]3d44s2→[Ar]3d54s1
B.![]()
C.![]()
D.![]()
(2)锂离子电池是现代高性能电池的代表,LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为___,P、O、S的第一电离能从大到小的顺序为___。
(3)在硫酸铜溶液中加入过量KCN,可生成配位化合物离子[Cu(CN)4]2-,则1mol[Cu(CN)4]2-中含有的σ键的数目为___;写出一种与CN-互为等电子体的单质的分子式___。
(4)钙和钴都是第四周期元素,且原子的最外层电子数相同,钴的熔沸点远高于钙,其原因是___。
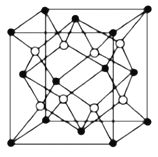
(5)Na2S的晶胞结构如图所示。已知Na+的半径为0.102nm,S2-的半径为0.184nm,则Na2S的晶胞参数a=___cm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲同学用图1所示实验装置测定锌与稀硫酸反应的速率
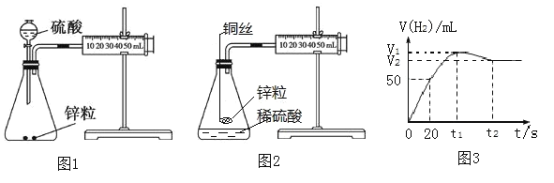
(1)甲同学测得产生H2体积与反应时间的关系如图3所示,该条件下气体摩尔体积为25 L·mol-1 ,溶液体积为40 mL,在20 s内用Zn2+浓度表示的平均反应速率v(Zn2+)=_____________mol·(L·s)-1。
(2)实际测定中发现在t1到t2时段,H2的体积变化如图3所示,试分析变化的原因:________
(3)乙同学认为图1装置中硫酸溶液的体积对H2的体积测定存在一定的影响 ,将实验装置进行如图2所示改进,结果发现产生氢气的速率发生明显变化,分析可能的原因________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应路线及所给信息填空。

(1)烃A的结构简式是___________,名称是___________________。
(2)①的反应类型是:_____________。③的反应类型是:______________。
(3)反应④的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸的质量分数为![]() ,密度为
,密度为![]() 。
。
(1)此盐酸的物质的量浓度为____________。
(2)需要![]() 的盐酸,配制时需以上浓盐酸的体积为_____
的盐酸,配制时需以上浓盐酸的体积为_____![]() 。
。
(3)上述实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒以及____________(两种仪器)。
(4)用浓盐酸配制![]() 稀盐酸,操作步骤的正确顺序是__________(填字母代号)。
稀盐酸,操作步骤的正确顺序是__________(填字母代号)。
a.计算需要浓盐酸的体积
b.用量筒量取浓盐酸
c.将烧杯中的溶液注入所需容积的容量瓶中,并用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶
d.把量好体积的浓盐酸倒入烧杯中,加适量蒸馏水稀释,冷却
e.盖好瓶塞,反复上下颠倒,摇匀
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm处,改用某仪器小心滴加蒸馏水至凹液面与刻度线相平
(5)下列操作使溶液物质的量浓度偏高的是:____________。
A.量取浓盐酸时仰视刻度线
B.容量瓶洗净后未经干燥处理
C.未冷却至室温就转移定容
D.没有将洗涤液转移到容量瓶中
E.定容时俯视刻度线
F.摇匀后立即观察,发现溶液未达到刻度线,再加几滴蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、C、N、O、V(钒)五种元素形成的某分子结构如图所示,下列说法错误是
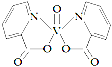
A.N原子核外存在3种不同能量的电子
B.基态V原子的价电子轨道表示式为![]()
C.基态O原子,电子占据的最高能级符号为2p
D.基态C、N两种原子中,核外存在相同对数自旋方向相反的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
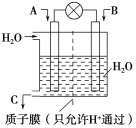
①若A为CO,B为H2,C为CH3OH,则通入CO的一极为___极,该极的电极反应式为___。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为___。
③若A为NH3,B为O2,C为HNO3,则正极的电极反应式为___。
④若用上述①作电池电解200mL含有0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(电极均为惰性电极),当消耗标况下0.448LH2时,阳极产生的气体为___(填化学式),其物质的量为___,溶液的pH=___(忽略铜离子水解,假设电解前后溶液体积不变)。
(2)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置(均为惰性电极)
Cr2O72-+H2O设计图示装置(均为惰性电极)
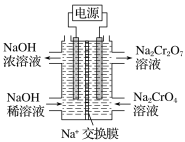
电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的___极,其电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、 D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是______(填元素符号),其中C原子的核外电子排布式为__________。
(2)A和D与氢元素形成的最简单氢化物中,其中沸点较高的是_____(填分子式),原因是________________;A和B的氢化物所属的晶体类型分别为______和______。
(3)C和D反应可生成组成比为1:3的化合物E, E的立体构型为______,中心原子的杂化轨道类型为______。
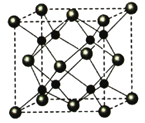
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞边长a=5.66x10-8cm, F 的化学式为______:晶胞中A 原子的配位数为_________;列式计算晶体F的密度(g·cm-3)_______________________________。(列算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) +Cu(s) =Cu2+(aq) +2Ag(s)设计的原电池如图所示。请回答下列问题:
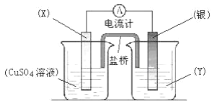
(1)电极 X 的材料是_____; 电解质溶液 Y 是________;
(2)银电极为电池的_____极,发生的电极反应为____________X 电极上发生的电极反应为__________
(3)外电路中的电子是从_____电极流向_____电极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com