
| A. | H+H→H2 | B. | I2→I+I | C. | 木炭燃烧 | D. | 铝与稀盐酸反应 |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸、所有中和反应;绝大多数化合反应、置换反应;少数分解、复分解反应.
常见的吸热反应有:个别的化合反应(如C和CO2),绝大数分解反应、少数置换以及某些复分解反应(如铵盐和强碱).
物质在溶解时经常伴随有吸热或放热现象,氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低.
断裂化学键吸热,形成新的化学键放热.
解答 解:A.H+H→H2为氢原子与氢原子共用电子对,形成新的化学键H-H键放热,故A错误;
B.I2→I+I为碘原子、碘原子间共用电子对断裂,断裂化学键吸热,故B正确;
C.木炭燃烧,放出热量,属于典型的放热反应,故C错误;
D.所有金属与酸反应为放热反应,铝与稀盐酸反应属于放热反应,故D错误;
故选B.
点评 本题考查化学中吸热或放热问题,熟记吸热或放热的判断规律是正确解答此类题的关键,题目难度不大.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 过程的自发性只能用于判断过程的方向性,不能确定过程是否一定会发生和过程发生的速率 | |
| B. | 空气污染日报中的空气污染指数的主要项日有可吸入颗粒物、二氧化硫、二氧化氮 | |
| C. | 金属冶炼过程主要是利用金属矿物中的金属离子失去电子变成金属单质所发生的氧化还原反应 | |
| D. | 糖类和油脂是重要的基本营养物质,并且是人体所需能量的重要来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
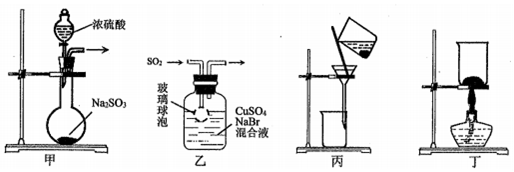
| A. | 用装置甲制取SO2 | B. | 用装置乙制取CuBr | ||
| C. | 用装置丙避光将CuBr与母液分离 | D. | 用装置丁干燥CuBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a=b+c时,B的物质的量分数变大 | B. | 若a=b+c时,B的体积分数不变 | ||
| C. | 若a>b+c时,A的转化率变小 | D. | 若a<b+c时,A的转化率变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2与SO3互为同分异构体 | |
| B. | 氢气是理想的绿色能源 | |
| C. | 单质中不存在化学键 | |
| D. | 电解饱和氯化钠溶液可能得到金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在合成塔中加入3molH2与1molN2反应即可得到2molNH3 | |
| B. | 工业上合成SO3时可加入过量空气以提高SO2的转化率 | |
| C. | 利用Al、Mg、NaOH溶液、导线及电流计等可证明Al的金属活动性大于Mg的 | |
| D. | 冰箱保存的食品不易变质,与化学反应速率无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此配合物,中心离子的配位数为4 | |
| B. | H2O为配体,配位原子是氧原子 | |
| C. | 此配合物中,Cu2+提供孤对电子 | |
| D. | 向此配合物溶液中加入BaCl2溶液,出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向0.1mol/LNH4HSO4溶液中滴加NaOH溶液至中性C(Na+)>c(SO42-)>c(NH4+)>c(OH-)=C(H+) | |
| B. | 向饱和NaClO溶液中滴加少量饱和FeSO4溶液,反应的离子方程式为2Fe2++ClO-+5H2O═2Fe(OH)3↓+Cl-+4H+ | |
| C. | 0.2mol•L-1CH3COOH溶液与0.1mol•L-1 NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH2COO-)-c(CH2COOH) | |
| D. | 常温下cmol/L、电离常数为Ka的酸HA溶液中,由水电离的浓度为c(H+)水=$\frac{1{0}^{-14}}{\sqrt{Ka•c}}$mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com