
溴酸银(AgBrO3)溶解度随温度变化曲线如图
所示,下列说法错误的是
A.溴酸银的溶解度是放热过程
B.温度升高时溴酸银溶解速度加快
C.60℃时溴酸银的Ksp约等于6×10-4
 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列方法中,正确的是
A.用湿润的红色石蕊试纸检验氨气
B.在样品溶液中先加入硝酸银溶液,再加入稀硝酸,若白色沉淀存在,则样品中含有Cl—
C.将熟石灰和氯化铵混合加热,可以制备氨气
D.将烧瓶中的浓氨水加热
查看答案和解析>>
科目:高中化学 来源: 题型:
化学式为C8H10O的化合物A具有如下性质:
 |
①A+Na—→慢慢产生气泡 ②A+RCOOH 有香味的产物
 ④其催化脱氢产物不能发生银镜反应
④其催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应可制得一种塑料品(它是目前造成“白色污染”的主要
污染源之一)
(1)根据上述信息,对该化合物的结构可做出的判断是 。
A.苯环上直接连有羟基 B.苯环侧链末端有甲基 C.肯定有醇羟基 D.肯定是芳香烃
(2)化合物A的结构简式为 ;
(3)A和金属钠反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )


A.将茶叶灼烧灰化,选用①、②和⑨
B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦
C.过滤得到的滤液,选用④、⑤和⑦
D.检验滤液中的Fe3+,选用③、⑧和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是最重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
⑴氢气是清洁能源,其燃烧产物为 。
⑵NaBH4是一种重要的储氢载体,能与水反应生成NaBO3,且反应前后B的化合价不变,该反应的化学方程式为,反应消耗1molNaBH4时转移的电子数目为。
⑶储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。

 (g)
(g)


 (g)+3H2(g)
(g)+3H2(g)
在某温度下,向恒容容器中加入环已烷,其起始浓度为amol·L-1,平衡时苯的浓度为bmol·L-1,该反应的平衡常数K=
⑷一定条件下,题11图所示装置可实现有机物的电化学储氢(忽略其它有机物)。


①导线中电子转移方向为 。(用A、D表示)
②生成目标产物的电极反应式为 。
③该储氢装置的电流效率η= 。(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位。)
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是重要的有机化工原料,可由乙烯气相直接水合法间接水合法生产,回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇,写出相应反应的化学方程式__________________________________。
(2)已知:
甲醇脱水反应 2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=-23.9kJ/mol
甲醇制烯烃反应 2CH3OH(g)=C2H4(g)+2H2O(g) △H=-29.1kJ/mol
乙醇异构化反应 C2H5OH(g)=CH3OCH3(g) △H=+50.7kJ/mol
则乙烯气相直接水合反应C2H4(g)+2H2O(g)= C2H5OH(g)的△H=________kJ/mol,与间接水合法相比,气相直接水合法的优点是___________________________。
(3)下图为气相水合法中乙烯的平衡转化率与温度、压强的关系(n(H2O):n(C2H4)=1:1)。
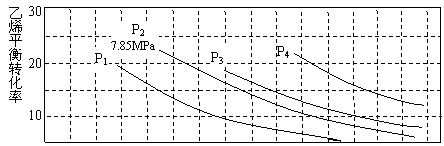 |
|
①列算式计算乙烯水合制乙醇反应在图中A点的平衡常数Kp=_______________
_____________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(P1、P2、P3、P4)的大小顺序为___________,理由是_________________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃、
压强6.9MPa,n(H2O):n(C2H4)=0.6:1。乙烯的转化率为5%,若要进一步提高乙烯转化率,除了可以适当改变温度和压强外,还可以采取的措施有___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+ H2O  HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO  H+ + ClO- Ka=?
H+ + ClO- Ka=?
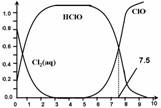 其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是
A.Cl2(g)+ H2O  2H+ + ClO- + Cl- K=10-10.9
2H+ + ClO- + Cl- K=10-10.9
B.在氯处理水体系中,c(HClO) + c(ClO-) =c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
化学变化不能实现的是________。
①一种原子变成另一种原子 ②一种离子变成另一种离子
③一种分子变成另一种分子 ④一种单质变成另一种单质
⑤一个质子变成一个中子 ⑥混合物变成纯净物 ⑦有毒有污染的物质变成无毒无污染的物质 ⑧金属变成非金属
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列反应的离子方程式:
(1)Ba(OH)2溶液与(NH4)2SO4溶液混合:____________________________________。
(2)CuSO4溶液与Ba(OH)2溶液混合:_______________________________________。
(3)NH4HCO3与过量NaOH溶液混合:______________________________________。
(4)Ba(OH)2与H2SO4两稀溶液混合:_______________________________________。
(5)Fe2O3溶于HI溶液中:________________________________________________。
(6)FeBr2溶液中通入过量Cl2:____________________________________________。
(7)FeO溶于稀HNO3中:_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com