
| A. | 打开啤酒瓶后,瓶中立即泛起大量泡沫 | |
| B. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| C. | 在溴水中存在如下平衡:Br2+H2O?HBr+HBrO,当加入NaOH溶液后,颜色变浅 | |
| D. | 对于2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.气体的溶解度随温度的升高而减小,随压强的增大而增大,由气体的溶解度随压强的增大而增大,因此常温时打开汽水瓶时,瓶内的压强减小,因此瓶内的二氧化碳会从瓶中溢出,可以用勒夏特列原理解释,故A不选;
B.由于K为气态,将钾分离出来,降低了产物的浓度,平衡正向移动,能用勒夏特列原理解释,故B不选;
C.加入氢氧化钠后,氢氧化钠和酸反应生成盐和水促进溴和水反应,所以溶液颜色变浅,能用勒夏特列原理解释,故C不选;
D.增大压强,平衡不移动,但体积减小导致碘浓度增大,颜色变深,所以不能用勒夏特里原理解释,故D选;
故选D.
点评 本题考查化学平衡移动原理,明确平衡移动原理内涵及适用范围是解本题关键,易错选项是D,注意只有改变条件时平衡发生移动才能用平衡移动原理解释,否则不能解释.


科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图.
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图. H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
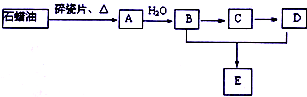 A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略).
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有浓郁香味、不溶于水的烃的衍生物.A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略). ;
; ,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.
,90g乳酸与足量金属钠完全反应产生的气体在标准状况下的体积是22.4L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大S02的浓度 | B. | 提高O2与SO2的体积比 | ||
| C. | 减小压强 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 在化合物中呈+3价 | |
| C. | 单质铊与同浓度的盐酸反应比铝剧烈 | |
| D. | 铊的还原性比铝的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
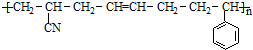 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和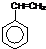 (写结构简式).
(写结构简式).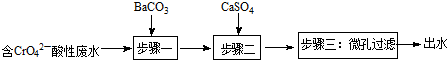
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com