
| A. | 该元素单质在常温下与水反应不如钠剧烈 | |
| B. | 该元素单质在常温下能与氧气反应 | |
| C. | 该元素最高化合价为+1 | |
| D. | 该元素氢氧化物的水溶液为强碱 |
分析 某主族元素的原子最外层只有一个电子,核外共有五个电子层,则该元素处于第五周期IA族,为Rb元素.
A.金属性越强,单质与水反应越剧烈;
B.金属性比Na活泼,常温下能与氧气反应;
C.主族元素最高正化合价等于最外层电子数;
D.金属性越强,氢氧化物的碱性越强.
解答 解:某主族元素的原子最外层只有一个电子,核外共有五个电子层,则该元素处于第五周期IA族,为Rb元素.
A.同主族自上而下金属性增强,故金属性Rb>Na,金属性越强,单质与水反应越剧烈,故该元素单质在常温下与水反应比钠更剧烈,故A错误;
B.金属性比Na活泼,常温下能与氧气反应,故B正确;
C.该主族元素的原子最外层只有一个电子,元素最高化合价为+1,故C正确;
D.该元素金属性比Na强,故该元素氢氧化物的水溶液为强碱,故D正确,
故选A.
点评 本题考查原子结构与元素性质,比较基础,注意理解同主族元素化合物性质的相似性与递变性.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 该有机物分子式为:C10H8O6 | |
| B. | 分子中最多有9个碳原子共平面 | |
| C. | 1 mol该有机物分别与足量NaOH溶液、NaHCO3溶液完全反应,消耗NaOH、NaHCO3的物质的量分别为4mol、1 mol | |
| D. | 该有机物可发生取代反应、还原反应,不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易液化 | |
| D. | 燃烧时主要是将化学能转变为热能和光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
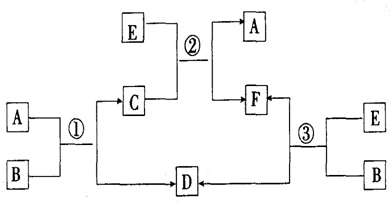
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
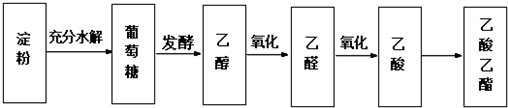
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
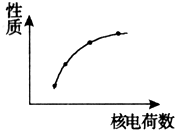 如图表示第IA族的金属元素的某些性质随核电荷数的变化关系.下列各性质中不符合图示关系的是( )
如图表示第IA族的金属元素的某些性质随核电荷数的变化关系.下列各性质中不符合图示关系的是( )| A. | 金属性 | B. | 阳离子的氧化性 | ||
| C. | 单质与水反应的剧烈程度 | D. | 最高价氧化物对应的水化物的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
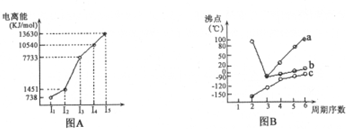
| 次氯酸 | 磷酸 | 硫酸 | 高氧酸 | |
| 含氧酸 | Cl-OH |  |  |  |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若起始时投入2mol SO2与1mol O2,则生成2mol SO3 | |
| B. | 若用18O2进行反应,则一段时间后,18O在反应物和生成物中均存在 | |
| C. | t min前,该反应的正反应速率大于逆反应速率 | |
| D. | 平衡时反应物与生成物浓度均不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com