
下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO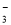 、AlO
、AlO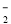 、K+、S2-等离子
、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
D
【解析】
试题分析:A、碳酸氢钠溶液中存在电离碳酸氢根离子,与偏铝酸根离子发生反应生成碳酸根离子和氢氧化铝沉淀,不可能大量存在,错误;B、若HA为强酸,则C(Na+) =C(A-);若HA为弱酸,则酸的浓度大于氢氧化钠的浓度,则等体积混合,酸过量,所得溶液为HA与NaA的混合液,溶液呈酸性,所以C(Na+) <C(A-),错误;C、醋酸加水稀释,醋酸的电离平衡正向移动,但醋酸根离子、氢离子浓度仍减小,但温度不变,水的离子积常数不变,则氢氧根离子浓度增大,错误;D、t℃时,水的离子积常数为Kw= c(OH-)×c(H+)=[c(OH-)]2,则c(OH-)=c(H+),所以溶液呈中性,正确,答案选D。
考点:考查离子大量共存的判断,酸碱混合的判断,溶液稀释离子浓度变化的判断,水离子积常数的应用


科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:实验题
实验题:(共15分)
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。
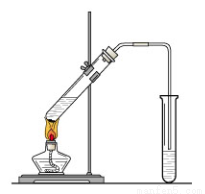
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是 。
(3)浓硫酸的作用是:① ; ② 。
(4)饱和碳酸钠溶液的主要作用是
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:实验题
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境中会生成单质S。
Ⅰ制备Na2S2O3·5H2O反应原理:Na2SO3(aq)+S(s) 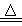 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
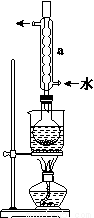
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)仪器a的名称是________,其作用是____________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是_________________ 。
Ⅱ测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O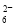 +2I-
+2I-
(3)滴定至终点时,溶液颜色的变化:________________________________。
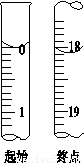
(4)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
(5)如果滴定终点时俯视刻度线,所的结果 (填“偏大”“偏小”或“不变”)
Ⅲ.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为______________________________________ ______。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸 ②用酒精洗涤粘有硫粉的试管 ③用托盘天平称量10.1g氯化钠晶体 ④实验中不慎将手指划破,可立即用FeCl3溶液止血 ⑤用瓷坩埚熔融NaOH ⑥用饱和NaHCO3溶液除去CO2中的少量SO2
A.①②③④ B.③④⑥ C.③④⑤ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.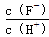 D.
D.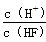
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:选择题
有平衡体系:CO(气) + 2H2(气)  CH3OH(气) ;ΔH<0为了增加甲醇的产量,工厂应采取正确的措施是
CH3OH(气) ;ΔH<0为了增加甲醇的产量,工厂应采取正确的措施是
A、高温、高压 B、适宜的温度、高压、催化剂
C、低温、低压 D、低温、低压、催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )| A、假蜜环菌甲素可以发生消去反应 |
| B、1 mol假蜜环菌甲素可与 6 molH2发生加成反应 |
| C、假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 |
| D、假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.61×10-1 | Kb=1.77×10 |
| Kw |
| Kb |
| Kw |
| Ka2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com