
【题目】从废钴酸锂电池正极片中(含LiCoO2、Al及少量铁、镁的化合物等)回收钴的工艺流程如下:
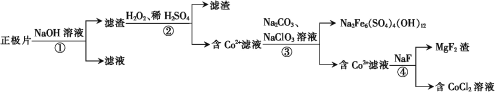
下列叙述错误的是
A.①中发生的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑
B.②中H2O2作还原剂
C.③中Na2CO3可用NaOH代替
D.④中除镁反应不宜在强酸条件下进行
【答案】C
【解析】
废钴酸锂电池正极片中(含LiCoO2、Al及少量铁、镁的化合物等),将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCoO2、Al及少量铁、镁的化合物;将滤渣用双氧水、硫酸处理后生成硫酸镁、CoSO4、Fe2(SO4)3,锂在滤渣中被除掉,再通过③除掉Fe3+,再通过④除掉镁元素,最后得CoCl2溶液。
A、①中反应是氢氧化钠和铝反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故A正确;
B、②中H2O2作将正三价Co还原为Co2+,H2O2作还原剂,故B正确;
C、③中Na2CO3如果用NaOH代替,则会生成氢氧化铁、氢氧化钴沉淀,降低了Co2+的回收率,故C错误;
D、④中除镁反应如果在强酸条件下进行,则NaF会生成有毒气体HF污染环境,且降低F-的浓度,影响镁的去除,故D正确。
答案选C。


科目:高中化学 来源: 题型:
【题目】NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。实验室制备少量NaClO2的装置如图所示。装置I控制温度在35~55°C,通入SO2将NaClO3还原为ClO2(沸点:11°C)。

回答下列问题:
(1)装置Ⅰ中反应的离子方程式为__________________。
(2)装置Ⅱ中反应的化学方程式为_____________________。
(3)装置用中NaOH溶液的作用是_____________。
(4)用制得的NaClO4/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)和溶液pH对脱硫、脱硝的影响如图所示:

①从图1和图2中可知脱硫、脱硝的最佳条件是n(H2O2)/n(NaClO2)=________________。pH在_________________之间。
②图2中SO2的去除率随pH的增大而增大,而NO的去除率在pH>5.5时反而减小。NO去除率减小的可能原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
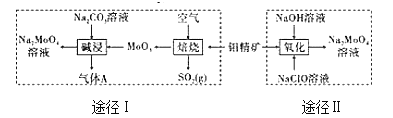
(1)途径Ⅰ还原剂与氧化剂物质的量之比为(不考虑杂质的反应)_____;碱浸时气体A的电子式为_______。
(2)途径II氧化时溶液中还有Na2SO4生成,则反应的离子方程式为____。
(3)已知途径I的钼酸钠溶液中c(MoO42-)=0.40 mol/L,c(CO32-)=0.40mol/L。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。当CO32-的除去率为90%时,列式计算此时是否有BaMoO4沉淀生成____。[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]
(4)途径II所得的BaMoO4溶液结晶后再经过重结晶可使钼酸钠晶体的纯度提高,其利用的原理是_____。
(5)某锂电池放电过程中,电极上发生Lix(MoS2)n与MoS2之间的转化。则电池放电时正极的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算填空:
(1)______mol CO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)3.01×1023个H2O所含电子的物质的量为________mol。
(3)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(4)标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体中甲烷的体积为______;一氧化碳的质量为_________。
(5)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mLO2和10mL F2,则A的化学式为_____。
(6)将5 mol·L-1的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO![]() 的物质的量浓度是______ mol·L-1。
的物质的量浓度是______ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是
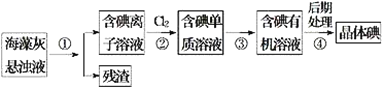
A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 1 mol硫单质在过量氧气中燃烧产生NA个SO3分子
B. 标准状况下,22.4 L SO3中含有氧原子数为3NA
C. 标准状况下,18 g H2O中含有氧原子数为NA
D. 5.4 g铝单质与足量NaOH溶液反应,转移电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co(CH3COO)2·4H2O(乙酸钴)是一种重要的有机化工原料。回答下列问题:
(1)以工业品氧化钴(CoO)为原料制备乙酸钴。(已知CoO与CH3COOH溶液反应缓慢,Co2+能与H+、NO3-大量共存)可能用到的试剂:Na2CO3溶液、CH3COOH溶液、HNO3溶液。先将CoO溶于____(填化学式,下同)溶液制得____溶液;在不断搅拌下,向制得的溶液中不断加入____溶液至不再产生沉淀,静置,过滤,洗涤;向沉淀中加入___溶液至沉淀完全溶解,调节pH约为6.8,经一系列操作得Co(CH3COO)2·4H2O。
(2)为探究乙酸钴的热分解产物,先在低于100 ℃时使其脱去结晶水,然后用下列装置进行实验(已知CO能与PdCl2溶液反应生成黑色Pd沉淀):
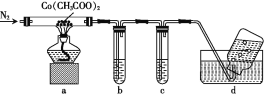
①通N2的目的是______。
②澄清石灰水和PdCl2溶液分别用于检验CO2和CO,其中盛放PdCl2溶液的装置是____(填字母)。
③实验结束时,为防止倒吸,正确的操作是______。
④装置a中完全反应后得到钴的一种氧化物,固体残留率(![]() ×100%)为45.4%。该氧化物为____。
×100%)为45.4%。该氧化物为____。
⑤装置a在加热过程中没有水生成,最终生成的固体氧化物质量为3.0125 g,装置b和c中的试剂均足量(b、c中得到固体的质量分别为2.5 g、10.6 g),集气瓶中收集到的气体为C2H6和N2,则装置a中发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R-NO2![]() R-NH2;②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:
R-NH2;②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备一系列化合物的转化关系图:
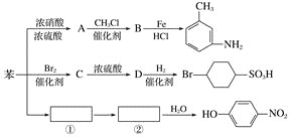
(1)A转化为B的化学方程式是______________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①②物质的结构简式:①__________,②_______。
(3)苯的二氯代物有________种同分异构体。
(4)有机物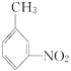 的所有原子________(填“是”或“不是”)在同一平面上。
的所有原子________(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL含有1mol/L的氯化铝溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的物质的量与所加碱的体积如图所示:
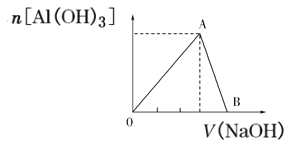
(1)写出OA段和AB段发生反应的离子方程式:OA段_____;AB段_____。
(2)A点溶液中的溶质为:____。(填化学式)
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是____mL或____mL。
(4)B点表示的氢氧化钠溶液的体积是___mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com