
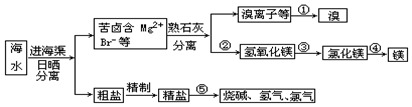
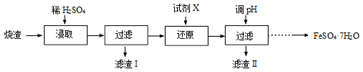
分析 海水暴晒然后分离得到粗盐和含有镁离子、溴离子的苦卤,向苦卤溶液中加入熟石灰,发生反应Mg2++2OH-=Mg(OH)2↓,向含有溴离子的溶液中加入氯水,发生反应2Br-+Cl2=2Cl-+Br2,然后萃取得到Br2,将Mg(OH)2溶于稀盐酸得到MgCl2,电解熔融氯化镁得到Mg,MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,提纯粗盐得到精盐,电解饱和食盐水得到烧碱、氯气和氢气,反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.
(1)溴离子具有还原性,被氧化剂氧化成溴单质;
(2)固液分离的方法为过滤;将Mg(OH)2溶于稀盐酸得到MgCl2;
(3)除去粗盐中的Ca2+、Mg2+、SO42-等杂质,镁离子用氢氧根离子沉淀,用碳酸根离子去除钙离子,用钡离子除去硫酸根离子,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,至于先除镁离子,还是先除硫酸根离子都行,但是加入的碳酸钠要放在加入氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,最后用盐酸;
(4)电解氯化钠发生:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,电解饱和食盐水在阴极得到氢气,阳极得到氯气,依据电解反应的化学方程式分析计算.
解答 解:(1)向含有溴离子的溶液中加入氯水,①发生反应:2Br-+Cl2=2Cl-+Br2,然后萃取得到Br2,
故答案为:2Br-+Cl2=2Cl-+Br2;
(2)分离出氢氧化镁属于分离溶液和固体,为过滤,将Mg(OH)2溶于稀盐酸得到MgCl2,
故答案为:过滤;盐酸;
(3)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,氢氧化钠溶液,最后加入盐酸,或加氯化钡溶液,氢氧化钠溶液,碳酸钠溶液,盐酸;(或氢氧化钠溶液,氯化钡溶液,碳酸钠溶液,盐酸),所以正确顺序为氯化钡溶液,氢氧化钠溶液,碳酸钠溶液,盐酸;(或氢氧化钠溶液,氯化钡溶液,碳酸钠溶液,盐酸);(或氯化钡溶液,碳酸钠溶液,氢氧化钠溶液,盐酸);
故答案为:氯化钡溶液,氢氧化钠溶液,碳酸钠溶液,盐酸(或氢氧化钠溶液,氯化钡溶液,碳酸钠溶液,盐酸);(或氯化钡溶液,碳酸钠溶液,氢氧化钠溶液,盐酸);
(4)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,电解食盐水时消耗NaCl的质量为234g,反应的氯化钠物质的量为$\frac{234g}{58.5g/mol}$=4mol,
2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑
4mol 2mol
氯气物质的量为1mol,标准状况下氯气体积为 2mol×22.4L/mol=44.8L,
故答案为:阴; 44.8.
点评 本题考查海水资源综合利用,涉及物质分离和提纯、电解计算等知识点,明确流程图中发生的反应及基本操作是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
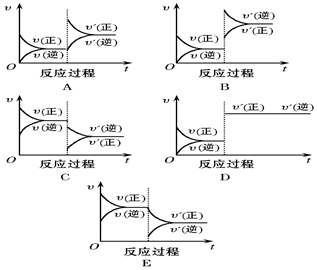 在一定条件下,反应A(g)+2B(s)?C(g)(正反应为吸热反应)达到平衡后,根据下列图象判断:
在一定条件下,反应A(g)+2B(s)?C(g)(正反应为吸热反应)达到平衡后,根据下列图象判断:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X的简单阴离子与Y的简单阳离子半径:X<Y | |
| B. | X分别与Z、W、Q形成的最简单化合物的稳定性:Z<W<Q | |
| C. | ZQ3分子中的所有原子最外层均满足8电子结构 | |
| D. | W、Q形成的含氧酸均为强酸. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 晚上在家闻到一股浓重的煤气味,赶紧开灯检查一下 | |
| D. | 浓硫酸溅到皮肤上,立即用稀氢氧化钠溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com