
 �ݱ�������һ�ֽ�Thibacillus Ferroxidans ��ϸ�������������µ�������Һ�У��ܽ���ͭ��CuFeS2�������������Σ������ķ�ӦΪ��
�ݱ�������һ�ֽ�Thibacillus Ferroxidans ��ϸ�������������µ�������Һ�У��ܽ���ͭ��CuFeS2�������������Σ������ķ�ӦΪ��| 1 |
| 2 |
| ||
| 0.025mol��2 |
| 0.5L |
| ||
| ||
| ||
| ||
| 1 |
| 2 |


 ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 һ���л���Ļ�ѧʽΪC4H4�����ӽṹ��ͼ��ʾ�������л���������������Ϻ���գ����ɵ�±����������У�������
һ���л���Ļ�ѧʽΪC4H4�����ӽṹ��ͼ��ʾ�������л���������������Ϻ���գ����ɵ�±����������У�������| A��2 | B��4 | C��5 | D��6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaI��NaIO3��һ���������ܷ�Ӧ����I2 |
| B��I2�ڷ�Ӧ�����ǻ�ԭ����ڷ�Ӧ�������������� |
| C��������Ӧ�����ɵ�����I2ʱת�Ƶ�������� |
| D�������ԣ�Mn02��SO42-��I03-��I2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ԭ�Ӱ뾶��W��Z��Y��X |
| B��ZԪ�������ڱ���λ��Ϊ�������ڵڢ�A�� |
| C�������ȶ���С�ڼ��� |
| D������ˮ��Һ�ʼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
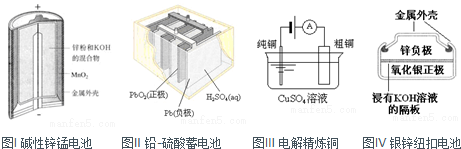
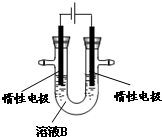
| A��ͼI��ʾ����У��������Ǵ��� |
| B��ͼ����ʾ��طŵ�����У�����Ũ�Ȳ������� |
| C��ͼ����ʾװ�ù��������У��������Һ��Ũ��ʼ�ղ��� |
| D��ͼIV��ʾ����У�������������ع��������л�ԭΪAg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1mol Na2O2������CO2��ַ�Ӧת�Ƶĵ�����Ϊ2NA |
| B�������£�pH=1�Ĵ�����Һ�У�������ӵ���Ŀһ������0.1NA |
| C����FeI2��Һ��ͨ����������������1molFe2+������ʱ���ܹ�ת�Ƶ��ӵ���ĿΪNA |
| D��t��ʱ��1L pH=6�Ĵ�ˮ�У���1��10-6 NA��OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Fe��NO3��3���������HI��Һ��2Fe3++2I-�T2Fe2++I2 |
| B������þ��Һ������������Һ��ϣ�SO42-+Ba2+�TBaSO4�� |
| C������������ʵ���Ũ�ȵ�NaHCO3��Һ��Ba��OH��2��Һ��ϣ�HCO3-+Ba2++OH-�TBaCO3��+H2O |
| D��Cu��������ϡ���Cu+2NO3-+4H+�TCu2++2NO2��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��̫���ܡ������ܡ����ܵȾ���������Դ |
| B������̼����ָ���ú�̼���͵����������ȼ�� |
C�� ���龭һ�ȼ���ת���ɵ�̼ϩ����;�������ˡ����ܼ��š�˼�� |
| D�����ٻ�ʯ��Դ��ʹ���ܼ���CO2���ŷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
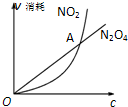 ��֪���淴Ӧ��2NO2��g��N2O4��g���У�NO2��N2O4��������������Ũ�ȴ������¹�ϵ��v��NO2��=k1?c2��NO2����v��N2O4��=k2?c��N2O4��������k1��k2��ֻ���¶��йصij�������һ���¶��¸���������ϵʽ������ͼ��ϵ������˵����ȷ���ǣ�������
��֪���淴Ӧ��2NO2��g��N2O4��g���У�NO2��N2O4��������������Ũ�ȴ������¹�ϵ��v��NO2��=k1?c2��NO2����v��N2O4��=k2?c��N2O4��������k1��k2��ֻ���¶��йصij�������һ���¶��¸���������ϵʽ������ͼ��ϵ������˵����ȷ���ǣ�������| A��ͼ��A���Ӧ��״̬��ʾ�÷�Ӧ�ﵽ��ѧƽ�� |
| B����ij�¶�ʱk1=k2������¶��·�Ӧ��ƽ�ⳣ��K=0.5 |
| C����1L�ܱ������г���1 mol NO2��ƽ��ʱ��c��NO2��+c��N2O4��=1 mol?L-1 |
| D����1L�ܱ������г���1 mol NO2����c��NO2��=c��N2O4��ʱ��NO2��ת������33.3% |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com